 로그인을 하시면 메디칼타임즈의
로그인을 하시면 메디칼타임즈의다양한 연관서비스를 이용하실 수 있습니다. 가입 시 등록한 정보를 입력해주세요.
 개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.
개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.안전한 개인정보 보호를 위해 3개월마다 비밀번호를 변경해주세요. ※ 비밀번호는 마이페이지에서도 변경 가능합니다.
- 제약·바이오
- 외자사
킴리아 국내 도입 4년…CAR-T 치료제 개발 기술도 일취월장
-
가
-
노바티스, 혈액암 환자 대상 제조 성과 등 공개
예스카타 허가로 임상현장 치료제 선택지 커져
'기적의 항암제'로 불리며 국산 1호 첨단바이오의약품으로 허가받은 한국노바티스 CAR-T 치료제 '킴리아(티사젠렉류셀)'.
국내 도입된 지 4년이 지난 시점에서 국내 CAR-T 치료제의 제조 역량 및 공급체계가 빠르게 개선되며 안착에 성공한 것으로 나타났다.
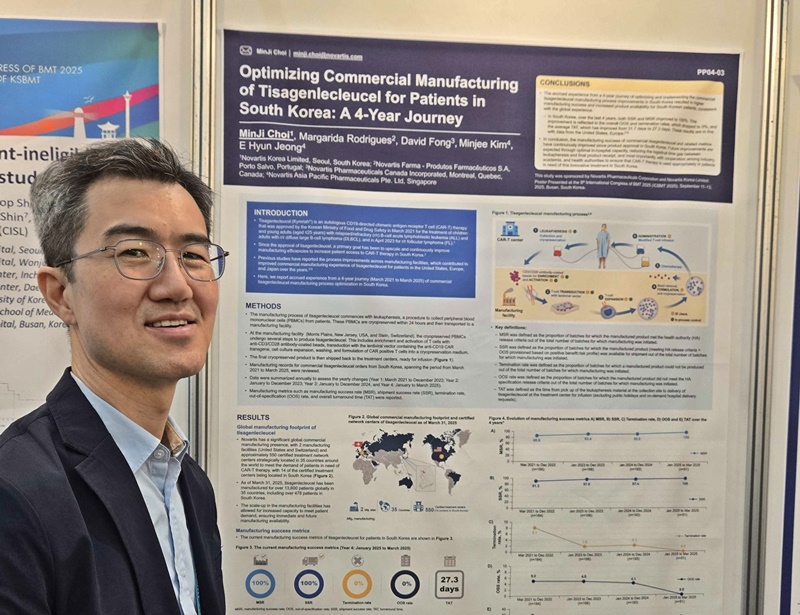
15일 제약업계에 따르면, 한국노바티스는 최근 부산 벡스코(BEXCO)에서 열린 대한조혈모세포이식학회 국제학술대회(International Congress of BMT, ICBMT 2025)에서 '킴리아'의 국내 혈액암 환자 대상 제조 경험 및 성과를 담은 연구 초록을 발표했다.
이번 분석은 2021년 3월부터 2025년 3월까지 킴리아를 제조‧공급한 총 574건의 사례를 ▲제조 성공률(Manufacturing Success Rate, MSR) ▲출고 성공률(Shipment Success Rate, SSR) ▲제조 중단률(Termination Rate, TR) ▲기준 규격 일탈 제품 발생률(Out-of-Specification, OOS) ▲평균 제조 기간(Turn-around Time, TAT) 총 5가지 평가 지표로 분석한 결과이다
킴리아는 지난 2021년 3월, 25세 이하의 소아 및 젊은 성인 환자에서의 이식 후 재발 또는 2차 재발 및 이후의 재발 또는 불응성 B세포 급성 림프성 백혈병(B-cell acute lymphoblastic leukemia, ALL)과 두 가지 이상의 전신 치료 후 재발성 또는 불응성 미만성 거대 B세포 림프종(diffuse large B-cell lymphoma, DLBCL) 치료에 국내 적응증을 획득했으며, 2023년 4월 두 가지 이상의 치료 후 재발성 또는 불응성 소포성림프종(Follicular Lymphoma, FL) 성인 환자의 치료에 적응증을 확대한 바 있다.
주요 평가 지표 분석 결과, MSR은 평가 1년(2021년 3월-2022년 12월) 차 86.9%(n=164), 2년(2023년 1월-2023년 12월) 차 93.4%(n=166), 3년(2024년 1월-2024년 12월) 차 93.8%(n=193), 4년(2025년 1월-2025년 3월) 차 100%(n=51)로 지속적인 개선율을 보였다.
SSR은 평가 1년 차 91.3%에서 4년 차 100%로 개선되었으며, TR은 8.1%에서 0%로 OOS는 5%에서 0%로 감소한 것으로 나타났다.
특히 공휴일 및 병원 측 요청으로 인해 배송이 지연된 사례를 제외하면 환자의 T세포 채집 시점부터 제품이 최종적으로 병원에 도착하는 기간을 의미하는 TAT는 1년 차 31.7(n=145)일에서 4년 차 27.3(n=23)일로 단축된 것으로 나타났다.
서울아산병원 종양내과 윤덕현 교수(CAR-T센터장, 대한혈액학회 CAR-T 위원회 위원장)은 "이번 발표를 통해 제조 기간 단축과 제조 및 출고 성공률 향상 등 제조 역량 측면에서도 진전을 입증한 만큼 향후 더 많은 환자들에게 처방 기회가 확대되고 CAR-T 치료 접근성이 개선돼 국내 난치성 혈액암 치료에서 킴리아의 역할이 더욱 강화될 것으로 기대된다"고 설명했다.
한편, 최근 예스카타(엑시캅타진 실로루셀, 길리어드 사이언스 코리아)가 국내 허가를 받으면서 킴리아로 국한됐던 국내 CAR-T 치료제 선택지가 늘어날 전망이다.
예스카타의 경우 ▲1차 화학 면역요법 치료 이후 12개월 이내에 재발하거나 불응하는 DLBCL 성인 환자 ▲2차 이상의 전신 치료 후 재발성 또는 불응성 DLBCL 및 원발성 종격동 B세포 림프종(Primary Mediastinal Large B-cell Lymphoma, 이하 PMBCL) 성인 환자에 대한 치료제로 허가 받으며 킴리아와 적응증 면에서 유사하다.
향후 국내 정식으로 출시할 경우 임상현장에서 경쟁할 것으로 예상이 가능한 부분이다.
참고로 현재 국내에서 CAR-T 치료제 활용이 가능한 의료기관은 약 10여개 수준이다. 기존 빅5으로 꼽히는 5개 병원에 더해 여의도성모병원, 고대안암병원과 울산대병원. 순천향대서울병원까지 CAR-T 치료제를 활용한 치료를 할 수 있는 시스템을 완비한 것으로 나타났다.
익명을 요구한 한 상급종합병원 혈액내과 교수는 "킴리아가 국내 임상현장에서 급여 적용과 함께 빠르게 자리 잡았지만 모호한 급여기준을 둘러싸고 삭감 문제가 대두되면서 의료진들이 큰 혼란을 겪었다"며 "이를 둘라 싸고 급여기준 개선 작업 등을 거쳤지만 삭감을 둘러싸고 대형병원들이 소송전까지 벌이고 있다. 효과 논의와 함께 급여기준을 둘러싼 논의가 계속 필요한 이유"라고 강조했다.

관련기사
- 글로벌 시장 정체 빠진 예스카타…국내 시장은 안착할까 2025-08-12 05:30:00
- 8개 성분 급여재평가 하반기 진행…근거없으면 퇴출 후폭풍 2025-07-09 05:30:00
- 이중항체 신약 급여 등재 속도…'컬럼비'도 성공할까 2025-07-08 05:30:00
- 급여 첫 관문 통과한 엡킨리…킴리아와 경쟁 구도 가시화 2025-06-12 11:58:48
제약·바이오 기사
- 유영제약, 30억원 규모 생산설비‧리모델링 투자 진행 2025-09-15 08:58:37
- 적응증 확대 이어가던 케이캡 복합제 개발로 방향 트나 2025-09-15 05:30:00
- '브리비액트' 급여 전 대웅제약이 후발약 허가…확대 가능성 2025-09-12 11:40:34
- 식약처, 의약품 등 의료제품 임상통계 심사‧상담사례 제공 2025-09-12 11:09:48
- CDMO로 재미 본 제약사들...시설 늘리기 속 성과 예의주시 2025-09-12 05:30:00
제약·바이오 기사
많이 읽은 뉴스
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.



















- 최신순
- 추천순
댓글운영규칙ex) medi****** 아이디 앞 네자리 표기 이외 * 처리
댓글 삭제기준 다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입이 제한될 수 있습니다.
1. 저작권・인격권 등 타인의 권리를 침해하는 경우
2. 상용프로그램의 등록과 게재, 배포를 안내하는 게시물
3. 타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
4. 욕설 및 비방, 음란성 댓글