 로그인을 하시면 메디칼타임즈의
로그인을 하시면 메디칼타임즈의다양한 연관서비스를 이용하실 수 있습니다. 가입 시 등록한 정보를 입력해주세요.
 개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.
개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.안전한 개인정보 보호를 위해 3개월마다 비밀번호를 변경해주세요. ※ 비밀번호는 마이페이지에서도 변경 가능합니다.
- 제약·바이오
- 외자사
지난해 글로벌 신약 유효성분 84개…5년사이 2배 껑충
-
가
-
코로나 치료제 개발 영향 새로운 유효성분 역대 최고
미국 출시 72개 NAS 중 61%가 FDA 혁신신약 지정
지난해 글로벌 시장에서 84개의 '새로운 유효성분(NAS, new active substance)'가 출시되면서 역대 최고기록을 달성했다.
코로나 백신 및 치료제 개발이 성장에 영향을 미치긴 했지만 지난 2016년의 2배의 성장을 보여 앞으로 새로운 유효성분이 더 증가될 것이라는 예측이다.

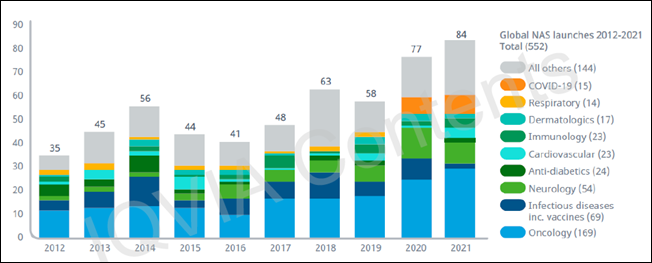
아이큐비아가 최근 발간한 '전 세계 신약 출시 및 R&D 파이프라인' 보고서를 살펴보면 2021년 전 세계에서 '신 유효성분(NAS)'이 84개 출시된 것으로 나타났다.
이는 지난 2016년 41개 대비 약 2배가량 성장한 수치로 코로나 이전 가장 높은 수치였던 2018년의 63개와 비교했을 때도 약 20개가량 차이가 났다.
연도별로 살펴봤을 때는 ▲2012년 35개 ▲2013년 45개 ▲2014년 56개 ▲2016년 41개 ▲2017년 48개 ▲2018년 63개 ▲2019년 58개 ▲2020년 77개 등으로 조사됐다.
국가별 NAS 출시 수치를 살펴보면 2002년부터 2021년까지 전 세계에서 총 883개의 NAS가 출시됐고 최근 5년 동안에는 329개가 출시된 것으로 나타났다.
이 중 미국에서 779개로 가장 많았으며, EU(프랑스, 독일, 이탈리아, 스페인, 영국)에서 603개로 두 번째로 많았다. 이어 중국에서 556개, 일본에서 564개가 출시된 것으로 분석됐다.
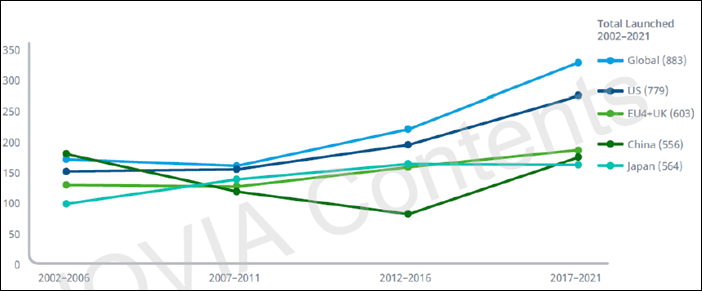
구체적으로는 미국에서는 최근 5년 동안 278개의 NAS가 출시됐으며 2021년에는 72개였다. 2021년 수치에는 코로나에 대한 저분자, 생물학적제제, 세포 요법, 긴급사용(EUA)이 포함됐다.
EU(EMA, 유럽의약청)에서는 최근 5년 동안 188개 출시가 이뤄져 미국보다 90개가 적은 것으로 나타났다. 아울러 2021년에는 46개로 집계됐다.
일본에서는 2021년 36개가 출시됐으며 4년 연속 30개 이상 출시를 기록했다. 해당 수치는 미국보다 낮은수치지만, 최근 가파른 증가세를 보였다.
2021년 유효성분의 역대 최고기록 달성은 8개의 코로나 백신 또는 치료제가 포함된 영향이 컸다는 게 아이큐비아의 분석.
또 지난해 미국에서 출시된 72개의 NAS 중 61%인 44개가 FDA에 의해 혁신신약(first-in-class)정해졌으며, 절반 이상이 희귀질환자를 위한 희귀의약품으로 지정받는 성과를 올렸다.
NAS를 효능별로 살펴보면 종양(Oncology), 신경(neurology) 감염병(infectious diseases) 등 3개 항목에서 2012년부터 2016년까지 221건 중 110건(49%)이었던 것에 비해 지난 5년 동안 330건 중 197건(60%)이 출시돼 점유율이 크게 늘어난 모습을 보였다.
이와 함께 만성 복합질환을 치료하는 데 사용되는 스페셜티(specialty) 의약품은 미국 전체 의료비의 약 50%의 점유율을 차지했으며, 이 중 최근 5년(2017~2021년) 동안 출시된 제품이 약 70%의 비중을 보인 것으로 분석됐다.
아울러 과거에는 첨단 치료법에 사용되는 제품 대부분이 주사제로 투여됐지만 최근 5년 동안 출시된 의약품은 49%가 경구 투여제였다.
눈에 띄는 점은 미국 식품의약국(FDA) 승인결정에 사용된 규제제출 자료가 실제임상근거(RWE) 등 임상개발에 대한 치료혁신 접근법의 다양성이 반영된 임상 디자인 사용이다.
지난 10년 동안 RWE는 2021년 11개 약물을 포함해 기존 약물의 새로운 승인 또는 확장된 사용에 31회 이용됐다.
일반적인 RWE 제출에는 자연경과연구(natural history studies), 전자의무기록(EMR) 또는 레지스트리 분석, 또는 미국보다 일찍 약물이 승인된 다른 국가의 치료 데이터가 포함됐다.
아이큐비아는 "지난해 84개의 새로운 유효성분 출시는 새로운 치료제를 발견하고 개발 및 규제 승인을 받기 위한 바이오의학 혁신 시스템의 강점이 반영된 것"이라며 "FDA 승인의 기초로 사용되는 임상에서 인종 등의 과제가 남아있지만 최근 승인된 약물에서 진전을 보이고 있다" 말했다.

관련기사
- 의약품 급여 재평가 동시에 병‧의원 처방도 모니터링 2022-03-14 12:01:53
- 2형 당뇨병환자 지방간 치료, 로베글리타존 효과 2022-03-11 12:10:30
- 1조원 급여 재평가 속 학회 '입김'이 제약사 운명 좌우 2022-03-08 12:34:52
- 식약처 '브루킨사' 허가…중국 항암 신약 진입 예고 2022-02-25 16:30:18
- 코로나 이후 제약 산업 주요 키워드는?…'비대면‧RNA' 2022-02-22 05:30:00
제약·바이오 기사
- 티에스바이오 AACR 출사표…면역항암제 전임상 발표 2022-03-22 11:12:58
- LG화학, 유트로핀펜 전용 '스마트케이스' 제공 2022-03-22 10:32:35
- 바이오팜솔루션즈, 750억원 규모 Pre-IPO 투자 유치 2022-03-22 10:31:58
- 약제 협상 대상 확대하는 공단…한숨 쉬는 제약사들 2022-03-22 05:30:00
- 질병청, SK바이오 코로나 백신 1000만회분 선구매 2022-03-21 17:51:43
제약·바이오 기사
많이 읽은 뉴스
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.














/NewsMain.jpg)
- 최신순
- 추천순
댓글운영규칙ex) medi****** 아이디 앞 네자리 표기 이외 * 처리
댓글 삭제기준 다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입이 제한될 수 있습니다.
1. 저작권・인격권 등 타인의 권리를 침해하는 경우
2. 상용프로그램의 등록과 게재, 배포를 안내하는 게시물
3. 타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
4. 욕설 및 비방, 음란성 댓글