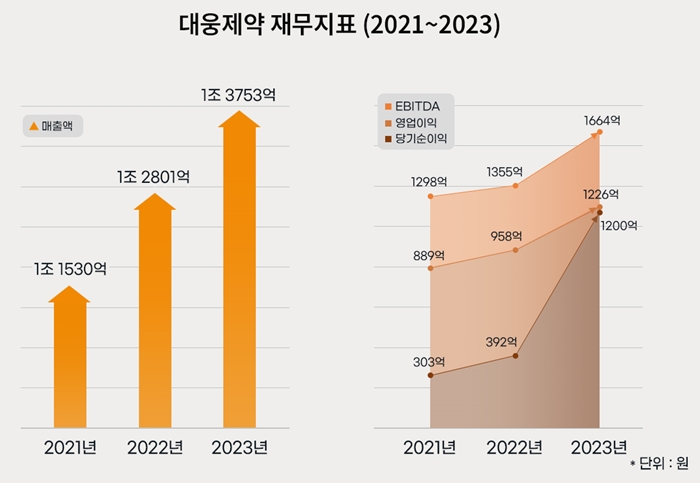
초점
차세대 항암 신약 봇물…AACR이 주목한 차기 주자는?
메디칼타임즈=문성호 기자글로벌 제약‧바이오 업계의 항암제 개발 트렌드를 확인할 수 있는 미국암연구학회 연례학술대회(AACR 2024)가 현지시각으로 10일 내년을 기약하며 막을 내렸다.지난 5일(현지시간)부터 10일까지 미국 샌디에이고에서 개최된 행사에는 전 세계 기업과 임상 연구진들은 그동안 진행해 온 항암제 초기 연구 결과를 발표하며 미래 청사진을 제시한 상황.행사 이전부터 주목받았든 주요 약물들의 경우 희망적인 결과를 발표하며 성공 가능성을 점쳤으며, 항체약물접합체(Antibody Drug Conjugate, ADC)와 이중항체로 대표되는 항암제 치료제 개발 트렌드도 재확인 했다.국암학회 연례학술대회(AACR 2024)가 지난 5일(현지시간)부터 10일까지 미국 샌디에이고에서 개최됐다.허가 기대 '크라자티‧린보셀타맙'이번 AACR에서 주목받은 약물이 있다면 올해 허가를 기대 받고 있는 '크라자티'와 '린보셀타맙'이다. 이들 두 치료제는 각각 '대장암'과 '다발골수종'에서 희망적인 연구 결과를 발표하며 큰 주목을 받았다.우선 브리스톨마이어스스큅(BMS)은 KRAS G12C 억제제 크라자티(아다그라십)와 전이성 대장암 표적치료제로 쓰이는 '세툭시맙'과 병용 효과를 확인한 임상1/2상 KRYSTAL-1 연구 업데이트 결과가 공개했다.이번 연구는 KRAS G12C 유전자 변이 대장암 환자 94명을 대상으로 크라자티와 세툭시맙 병용요법의 효능과 안전성을 평가한 것이다. 여기서 'KRAS G12C 돌연변이'는 대장암의 약 4%에서 발생하며 예후가 좋지 않은 것으로 알려져 있다.연구 결과를 살펴보면, 1차 평가변수였던 객관적 반응률(ORR, overall response rate)은 34%였다. 무진행생존기간 중앙값(mPFS)은 6.9개월, 전체생존기간 중앙값(mOS)은 15.9개월로 나타났다.기존 표준 치료요법의 ORR이 1~6%, mPFS와 mOS가 각각 1.9~5.6개월, 4~10.8개월인 점을 고려했을 때 개선된 데이터다. FDA로부터 처방자 수수료법(PDUFA)에 따라 오는 6월 22일 허가 여부가 결정될 예정인 가운데 발표된 내용이라 희망적으로 해석된다. MD앤더슨 암센터 스콧 코펫츠(Scott Kopetz) 교수발표를 맡은 텍사스대 MD앤더슨 암센터 스콧 코펫츠(Scott Kopetz) 교수는 "이전에 치료를 받은 KRAS G12C 유전자 변이 대장암 환자에 대한 치료 옵션은 제한적"이라며 "크라자티와 세툭시맙의 병용요법은 이전에 치료를 받은 KRAS G12C 변이 대장암 환자를 위한 잠재적인 새로운 표준 치료법이 될 수 있다"고 시사했다. 크라자티와 마찬가지로 오는 8월 허가 여부가 결정될 예정인 미국 리제네론의 '린보셀타맙'도 AACR을 통해 희망적인 임상 데이터가 공개되며 기대감을 키웠다. 현재 린보셀타맙은 FDA로부터 패스트트랙 지정을 받아 다발골수종 치료에 대한 우선 심사를 받고 있다. 현재 허가 검토 발표는 오는 8월로 예정돼 있다.AACR을 통해 리제네론은 재발·불응성(R/R) 다발골수종 환자를 대상으로 한 임상1·2상(LINKER-MM1)을 공개했다. 린보셀타맙은 다발골수종 세포의 B세포 성숙 항원(BCMA)과 CD3 발현 T세포를 표적으로 한 이중항체다. 재발·불응성 다발골수종 환자 117명을 대상으로 11개월 간 추적 관찰한 결과 ORR이 71%로 1차 평가 변수를 충족했다. 임상에 참여한 환자 중 46%가 종양이 완전히 소실된 '완전관해(CR)'에 도달했다.전체 환자 중 62%가 '매우 우수한 부분관해(VGPR)' 이상을 달성했다. 중앙 반응 기간(DoR), 중앙 무진행 생존(PFS) 및 중앙 전체 생존(OS)에는 도달하지 못했다. 다만, 치료 12개월 시점에서 DoR 예상 확률은 78%, PFS 비율 69%, OS 예상 비율은 약 75%로 평가됐다.뉴욕 마운트시나이병원 순다르 자간나스(Sundar Jagannath) 다발골수종센터 소장은 "최소 24주 동안 치료를 받은 환자들 중 대다수가 매우 좋은 부분 반응을 보여 2주 간격에서 4주 간격으로 투여를 전환할 수 있었다"며 "이는 임상시험을 통해 직접 확인한 성과로 오는 8월 FDA의 결정이 기대된다"고 말했다.차세대 PARP억제제 사루파립아스트라제네카의 PARP(다중 ADT당 중합효소) 저해제 후보물질 '사루파립'도 이번 AACR에서 주목받은 것 중에 하나다.AACR에서는 상동재조합복구결함(Homologous Recombination Repair-deficient, 이하 HRD) 유방암 환자에서의 효과를 확인한 1/2상 임상 PETRA 연구 결과가 공개됐다.MD 앤더슨 암센터의 티모시 얍(Timothy A. Yap) 교수PETRA 연구는 이전 치료 경험이 있는 306명의 환자를 대상으로 사루파립의 안전성, 내약성, 유효성을 평가하는 다기관 1/2상 임상시험이다. 환자들은 매일 10~140mg의 사루파립을 투여 받은 가운데 추가 임상 개발을 위해 매일 60mg을 투여하는 것을 권장 복용량으로 정했다. 사루파립 60mg으로 치료받은 유방암 환자 31명 중 ORR은 48.4%, 반응 지속기간 중앙값(mDOR)은 7.3개월, mPFS는 9.1개월로 나타났다.모든 암종에 걸쳐 60mg 용량을 투여한 141명 환자 중 92.2%에서 이상반응이 관찰됐고, 12.1%의 환자가 심각한 이상반응을 경험한 것으로 나타났다. 사루파립과 관련된 부작용은 환자의 76.6%에서 관찰됐으며, 2.1%의 환자는 약물과 관련된 심각한 부작용을 겪었고, 3.5%의 환자는 치료를 중단했다.텍사스대 MD 앤더슨 암센터의 티모시 얍(Timothy A. Yap) 교수는 "HRR 결핍 돌연변이가 있는 유방암, 난소암, 췌장암, 전립선암의 전임상 모델에서 유망한 종양 성장 억제를 보여줬다"며 "사루파립은 다른 PARP 억제제보다 독성이 낮기 때문에 더 높은 용량으로 투여할 수 있다"고 설명했다.이어 "사루파립에서 관찰된 낮은 용량 감소율은 관리하기 쉬운 안전성 프로파일을 시사한다"며 "환자가 최적의 용량에서 더 오래 투여 받을 수 있도록 해 장기적 혜택의 기회를 극대화할 수 있다"고 기대했다.차세대 ADC 약물 탄생할까여기에 최근 글로벌 항암제 시장에서 트렌드로 부상한 ADC 약물 후보의 임상결과도 공개됐다. 가장 관심을 모은 것은 미국 머크(MSD)의 TROP2 ADC '사시투주맙 타루모테칸(MK-2870)'이다. 해당 약물은 MSD가 중국 켈룬 바이오텍(Kelun Biotech)에 14억 1000만 달러 규모로 중국을 제외한 글로벌 권리를 사드린 차세대 ADC 후보물질이다.이번 AACR에서는 글로벌 항암제 트렌드로 부상한 ADC와 이중항체 기반 치료제가 각광을 받았다.(사진 출처 AACR)이번 AACR에서는 치료경험이 있는 진행성 위·위식도접합부(G/GEJ) 암 환자 41명을 대상으로 한 임상 2상 결과로, ORR 22%, 질병 통제율(DCR) 80.5%, DoR 7.5개월로 나타났다.3차례 이상 치료경험이 있는 환자들에 대한 하위분석 결과에서 PFS은 3.7개월, OS은 7.6개월이었다. 12개월간의 전체생존율은 32.6%였다.이 같은 결과에 바탕으로 MD 앤더슨 암센터(MD Anderson Cancer Center) 위 또는 위식도 접합부 선암종으로 이전에 최소 3개 라인의 치료를 받은 환자를 대상으로 사시투주맙 타루모테칸을 현재 표준 치료와 비교‧평가하기 위한 글로벌 3상 연구를 진행하기로 했다.