초기 백내장 진단시 약물치료 시행 43.5%…요오드 제제 선호
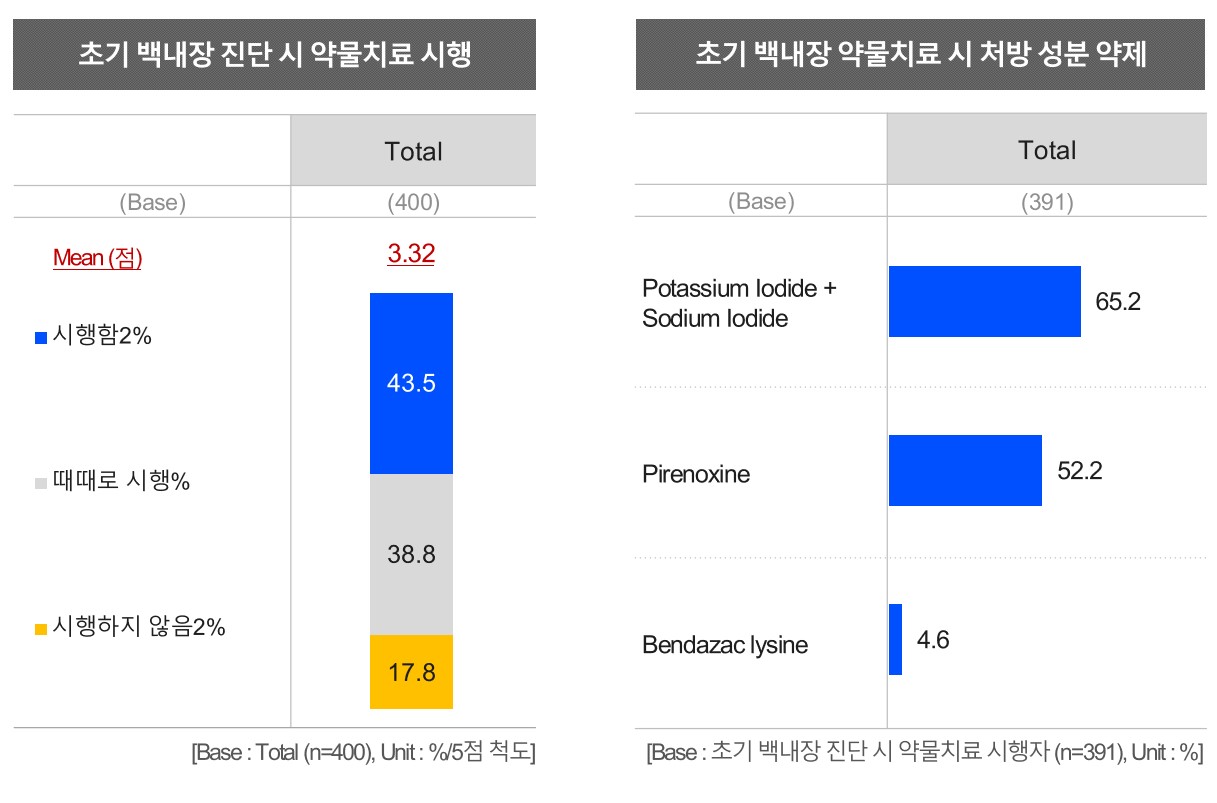
메디칼타임즈=허성규 기자초기 백내장 진단 시 43.5%가 약물치료를 시행하는 가운데 요오드 제제를 조금 더 선호하는 것으로 나타났다.아울러 실제 백내장 수술 전후 등에 처방하는 항균 점안액에서는 목시플록사신의 처방이 가장 높은 비중을 차지했다.메디칼타임즈는 지난 2월 13일부터 4월 5일까지 백내장 치료 및 수술 관련 현황 및 약물 관련 선호를 파악하고자 전국 안과 보건의료전문가 400명을 대상으로 온라인 설문조사를 진행했다.설문에 참여자의 세부 전공을 살펴보면 일반안과가 29.5%로 가장 많았고, 망막이 19.5%, 백내장이 14.8%, 전안부가 9.8%, 녹내장이 9%, 외안부가 8.8%, 각막이 6.8%, 성형안과가 6%, 굴절이 4%, 기타 2.3%로 구성됐다.또한 응답한 안과 의사 중 하루 진료 환자수는 50명 이상 100명 미만이 64%로 가장 많았고, 50명 미만이 20%, 100명 이상이 16%였다.이 중 일일 진료 백내장 환자수는 진료 10명이상 20명 미만이 34.3%로 가장 많았고, 5명 이상 10명 미만이 32%로 뒤를 이었다.설문에 참여한 안과 의사 중 43.5%가 초기 백내장 진단 시 약물치료 시행에 대해 '그렇다'고 답변했으며, 때때로 시행하고 있음은 38.8%로 초기에 약물 치료를 시행하는 모습이었다.이같은 초기 백내장 약물치료 시 처방 약제로 '요오드제제(Potassium Iodide + Sodium Iodide)'가 65.2%로 가장 높았으며, 다음으로 '피레녹신 제제(Pirenoxine)'가 52.2%였다.또한 백내장으로 진단해 약물치료 진행 시 백내장 진행경과를 살펴보기 위한 환자 팔롭 기간은 '3개월 마다'가 41.5%이며, 다음으로 '6개월 마다'가 22.8%였다.아울러 백내장 약물치료와 관련해 선호도가 높은 요요드 제제와 피레녹신 제제에 대한 제제별 처방율 및 처방이유를 별도로 살펴봤다.그 결과 백내장 약물치료 시 69.5%가 요오드 제제를 처방하고 있으며, 30.5%는 처방하지 않는 것으로 나타났다.요오드 제제 처방 이유는 '복용 순응도 좋은 용법 용량'이 71.9%로 크게 높았으며, 다음은 '투명한 용액(not suspension)으로 환자의 투약 편의성'이 37.1%인 것으로 파악돼 환자의 복약 순응도에 대한 비중이 큰 것으로 분석됐다.또한 피레녹신 제제 처방율은 47.8%이며, 52.3%는 처방하지 않는 것으로 나타났다.또 주목되는 점은 요오드 제제와 달리 피레녹신 제제의 처방 이유는 다소 균등한 모습을 나타냈고 이 중에서는 '익숙함/오래전 부터 사용'(16.2%) 및 '순응도가 좋아서'(13.1%)로 가장 높았으며 그 외에에는 '효과 우수'(9.9%), '점안감 우수'(9.4%) 등이 뒤를 이었다백내장 수술 시행 여부를 묻는 질문에는 전체 응답자의 78.3%가 '그렇다'고 답했고, 이 중 46.5%는 '매우 그렇다'고 응답했다.실제 수술 시행 연령대는 60대, 70대 이상이 각각 42.5%, 40.3%로 높은 비중을 차지했고 50대 이하는 17.2%였다.수술 후 각별한 주의가 필요한 환자로는 '포도막염으로 유발된 백내장', '외상성 백내장'이 각각 77.5%, 71.8%로 유사하게 높은 것으로 확인됐다.백내장 수술 전 안구건조증 진단/치료 시 수술결과 및 환자 만족도를 향상 시킨다는 연구결과에 대해서는 실제 임상 현장에서 체감하는 것으로 나타났다.수술 전 안구건조증 치료를 시행한 경우 수술 결과 및 만족도를 향상시킨다는 연구결과에 대해 전체 응답자의 65.5%가 체감하고 있었으며, 30.5%는 때때로 이를 경험하는 것으로 응답한 것.안구건조증 적극 치료 후 수술 시행에 대해 전체 응답자의 절반 정도인 49.8%가 그렇다고 응답했으며, 때때로라고 답한 비율이 33.8%로 확인됐다.실제 수술 전 건성안 치료 시 우선 기준 목표로 '염증(Inflammation) 치료'와 '눈물층 안정화'가 각각 66.3%, 61.8%로 가장 중요시 되는 것으로 파악됐고, '마이봄샘 기능장애(MGD) 치료'가 47.8%로 나타났다.수술 후의 경우 백내장 수술이 성공적으로 이뤄졌음에도 불구하고 안구건조증으로 인한 불편감 호소를 하는 환자 비율은 '10~30% 미만'이 절반 정도이며, 32.5%는 30% 이상이라고 답했다.수술 후 발생하는 안구건조증 치료 시 IPL 레이저 치료 시행에 대해 20.3%가 '그렇다'고 응답했고, 28.8%는 '때때로 시행'한 것으로 파악됐다.또 백내장 수술 후 안구건조증 치료 약제로는 '히알루론산(Hyaluronate)' 선호율이 74%로 가장 높았으며, 다음으로 '디쿠아포솔(Diquafosol)'이 62%를 차지했으며, '사이클로스포린(Cyclosporine)'은 31.5%였다.이외에도 백내장 수술 전, 당일, 수술 후에 모두 항균 점안액에서는 목시플록사신이 가장 높은 비중을 차지했다.수술 전 무균화 요법 위한 항균점안액 처방 현황을 살펴보면 주로 처방하는 항균점안액으로 '목시플록사신(Moxifloxacin(Bottle type))'이 55%로 가장 높은 비중을 차지했고 '레보플록사신(Levofloxacin(Bottle type))' 30.8%, '목시플록사신(Moxifloxacin(SDU))' 15.3% 순이었다.기타 의견으로 가티플록사신(gatifloxacin)과 오플록사신(ofloxacin)도 있었으며, '처방하지 않는다'는 응답도 일부 있었다.백내장 수술 전 무균화 요법을 위해서 항균제 외 점안제를 처방하는 비율은 21.5%로 높지 않았다.다만 이때 처방하는 점안제로는 NSAIDs 항염증제인 '브롬페낙(Bromfenac)'이 74.4%로 가장 높았고 다음으로 STEROID 항염증제인 '프레드니솔린(Prednisolone)'은 9.3%로 브롬페낙 제제를 더 선호했다.백내장 수술 당일 무균화 요법을 위해 주로 사용하는 항균점안액 역시 목시플록사신이 압도적이라는 점은 변하지 않았다.제제 별로는 '목시플록사신(Moxifloxacin(Bottle type))'이 53.8%로 가장 높은 비중을 나타냈고, '레보플록사신(Levofloxacin(Bottle type))'과 '목시플록사신(Moxifloxacin(SDU))'이 각각 19.8%, 17.5%로 뒤를 이었다. 또 기타의견으로 '베타딘', '가티플록사신(Gatifloxacin)', '포비돈' 등이 일부 응답됐다.백내장 수술 후 감염 예방을 위한 항균점안액 외래처방 약제에서도 '목시플록사신Moxifloxacin(Bottle type)'이 56.8%로 가장 높은 비중을 차지했다.이어 '레보플록사신(Levofloxacin(Bottle type))' 22%, '목시플록사신(Moxifloxacin(SDU))' 13.3% 순이었고, '가티플록사신(Gatifloxacin)'도 기타의견으로 응답된 것으로 확인됐다.백내장 수술 후 염증/상처 치료를 위한 항염점안액 처방 약제의 경우 '브롬페낙(Bromfenac_NSAIDs)'과 '프레드니솔론(Prednisolone_Steroid)'이 58.5%, 56.3%로 유사한 비율로 나타났고, '플루오로메톨론(Fluorometholone_Steroid)'이 42.3%였다.마지막으로 백내장 수술 전후의 제제별 처방 유익성을 조사한 결과 브롬페낙(Bromfenac) 제제 처방의 유익성은 '백내장 수술 후 나타나는 낭포황반부종(CME) 발생 억제 효과'가 74%로 크게 높았으며, 다음으로 '안압(IOP) 상승의 위험이 없이 수술 후 염증에 사용 가능'이 41%였고 사이클로스포린(Cyclosporine) 제제는 '눈물 생성 증가와 건조각막결막염과 관련된 안염증 치료가 동시에 가능한 점'이 51.3%로 가장 높았다.