사전심사 30년 조혈모세포 이식 '사후심사'도 병행
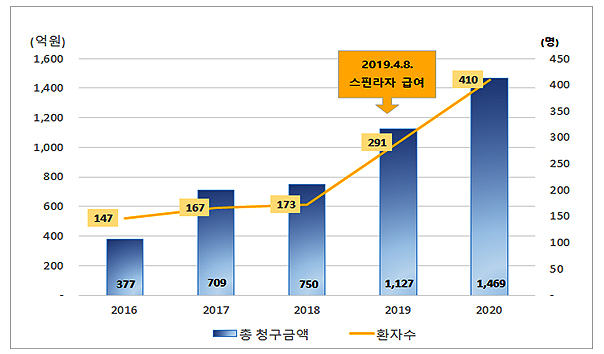
메디칼타임즈=박양명 기자내년부터 조혈모세포 이식이 '일반심사'로 전환된다. 사전승인 제도의 시발점이었던 조혈모세포 이식이 30년 만에 제도 밖으로 나오게 된 것.15일 의료계에 따르면, 보건복지부는 조혈모세포 이식을 일반심사로 전환해 사전승인과 병행한다는 내용을 담은 '조혈모세포 이식의 요양급여에 관한 기준' 전부개정안을 28일까지 행정예고했다.사전승인 제도는 고위험‧고비용이거나 대체 불가능한 행위 및 약제 항목에 대한 요양급여 적용 여부를 사전에 심의하는 제도다. 조혈모세포 이식은 사전승인 제도의 시작점으로 1992년 10월부터 사전승인을 통해 급여를 인정해왔다.자료사진. 복지부는 조혈모세포 이식 일반심사와 사전심사를 병행한다는 내용의 고시를 행정예고했다.현재는 조혈모세포 이식을 비롯해 ▲면역관용요법 ▲솔리리스주 ▲스트렌식주 ▲스핀라자주 ▲ICD&CRT ▲심실 보조장치치료술 ▲임상연구 ▲울토미리스주 등 9개 항목이 사전승인 대상이다.심평원은 그동안 심사가 안정화된 항목은 사후 심사로 바꿔야 한다는 지적을 받아왔었다.조혈모세포 이식이 대표적인 항목인 셈. 실제 지난 10월 열린 국정감사에서 강기윤 국민의힘 의원은 "조혈모세포 이식처럼 오랫동안 논의된 의료 행위나 약제는 사후승인 심사로 전환해야 한다"고 주장했다.30년 전만 해도 조혈모세포 이식은 고가의 의료 행위였다. 하지만 1회 투약 비용이 20억원에 달하는 초고가 신약이 나오고 있는 현재, 조혈모 세포 이식은 상대적으로 그 액수가 미미한 수준이다.심평원에 따르면, 지난해 기준 조혈모세포이식은 3323명이 혜택을 받아 총 1276억원이 들어갔다. 한 명당 3839만원 정도의 금액이다.솔리리스는 118명에게 혜택이 돌아갔고 367억원의 비용이 들어갔다. 한 명당 3억1101만원 상당의 금액인데, 조혈모세포 이식보다 8배나 많은 액수다. 2019년 5월 사전승인 항목으로 들어온 스핀라자 승인대상자는 지난해 149명으로 연간 소요비용은 416억원이다. 환자 한 명당 2억7919억원이나 된다.심평원 관계자는 "30년 전만해도 조혈모세포 이식 비용이 워낙 높았지만 솔리리스, 스핀라자, 울토미리스 등의 항목들의 인당 평균 소요 비용이 억 단위라서 상대적으로 낮은 편"이라고 말했다.조혈모세포 이식 심사, 어떻게 바뀌나개정안을 보면, 조혈모세포 이식이 완전히 일반심사로 전환되는 것은 아니다. 사전승인제도와 일반심사를 병행하는 형태로 운영될 예정이다.심평원 사전심사부 관계자는 "앞으로 조혈모세포 이식을 먼저 하고 청구가 가능해진다는 예정"이라며 "사전승인 대상 항목 중 조혈모세포 이식 건수가 여전히 많기 때문에 진료심사평가위원회 산하에 조혈모세포 이식 분과위원회도 계속 운영하며 사전승인도 병행할 것"이라고 말했다.조혈모세포 이식 대상자 및 실시 조항조혈모세포 이식 기관의 담당 의사가 환자에게 조혈모세포 이식이 진료상 필요하다고 판단하면 별도의 사전승인 절차를 거치지 않고 조혈모세포이식을 실시, 급여를 청구할 수 있다.조혈모세포 이식 실시기관 승인을 받은 의료기관에서 이식과 직접 관련된 진료 기간(조혈모세포 주입 전 1주부터 주입 후 2주)에 발생한 요양급여비를 청구하면 된다.다만 조혈모세포 이식 급여 기준에서 정하지 않은 질병이거나 조직형의 경우, 요양급여 대상여부를 실시기관 담당 의사가 판단하기 어려울 때는 요양급여 대상이 되는지 사전승인을 심평원에 신청할 수 있다.조혈모세포이식 실시기관에는 합병증이 발생된 경우 진료를 담당할 수 있는 과별 전문의가 상근해야 하는데, 감염내과 또는 소아청소년 감염 전문의도 포함시켰다.해당 고시는 내년 1월을 기준으로 3년이 되는 시점마다 법령이나 현실 여건 변화 등을 검토해 고시의 폐지, 개정 등의 조치를 하도록 했다.심평원 관계자는 "고가약이 계속 급여권으로 들어오면서 사전승인 항목도 늘고 있다 보니 제도의 효율화를 고민해야 하는 상황이 왔다"라며 "조혈모세포 이식이 가장 오래되기도 했고 30년을 운영하며 안정화가 됐기 때문에 일반심사로 전환해도 무리가 없겠다는 판단을 하게 됐다"라고 설명했다.이어 "올해 관련 학회 등 의료계를 비롯해 복지부와도 협의 과정을 거쳐 행정예고안이 나온 것"이라고 덧붙였다.