한미약품, 'BH3120'·키트루다 병용 임상…MSD와 계약 체결
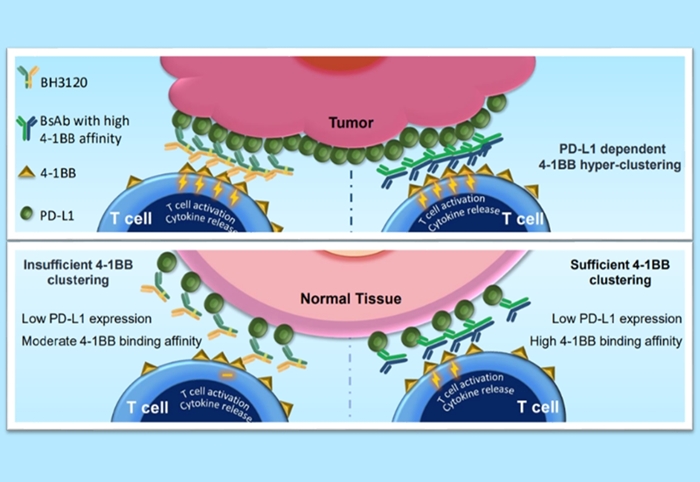
메디칼타임즈=허성규 기자한미약품은 MSD('Merck & Co., Inc., Rahway, NJ, USA'의 상호)와 이중항체 BH3120의 병용 임상 연구를 위한 '임상시험 협력 및 공급 계약(Clinical Trial Collaboration and Supply Agreement·CTCSA)'을 체결했다고 23일 밝혔다.한미약품은 이 CTCSA 체결 이후 진행성 또는 전이성 고형암 환자들을 대상으로 MSD의 면역항암제 키트루다(KEYTRUDA®, 성분명: 펨브롤리주맙·pembrolizumab)와 'BH3120'의 병용요법에 따른 안전성 및 유효성을 평가하기 위한 임상 1상을 진행하게 된다. 한미약품은 스폰서로서 해당 임상시험을 총괄 진행하고, MSD는 임상시험에 사용되는 키트루다를 공급한다.한미약품의 이중항체 'BH3120'의 작용 기전'BH3120'은 이중항체 플랫폼 기술 '펜탐바디'를 적용한 항암 신약으로, 현재 한미약품과 북경한미약품이 공동 개발 중이다. 펜탐바디는 하나의 항체를 두 개의 서로 다른 표적에 동시에 결합해 면역 항암치료와 표적 항암치료를 모두 가능하게 하는 기술이다.BH3120은 면역글로불린(lgG)과 유사한 형태의 이중 특이 항체로, PD-L1과 면역세포 표면의 4-1BB를 동시 타깃 하며 PD-L1에 대한 편향된 결합 친화력을 가지고 있다.이러한 BH3120의 디자인은, 특히 종양 미세환경(TME) 내 PD-L1이 과발현된 종양 조직에서 강력한 항종양 활성을 유도하는 동시에 정상 조직에서 과도한 면역 활성화를 최소화하는 것을 목표로 한다.4-1BB를 표적으로 하는 기존의 항암 치료제 대부분은 안전성 측면에서 한계를 갖고 있다. 반면 BH3120은 다양한 비임상 연구를 통해 종양미세환경(TME)과 정상조직 사이에서 면역 활성화의 뚜렷한 디커플링 현상을 보여주면서 효과적이고 안전한 항암제 개발 가능성이 확인되고 있다.BH3120의 한국/미국 임상 1상 시험 책임 연구자를 맡고 있는 김동완 서울대병원 임상시험센터장(혈액종양내과 교수)은 "MSD와의 협력을 통해 BH3120과 키트루다의 병용요법이 재발성 또는 불응성 환자들의 치료 결과를 개선할 수 있을 것으로 기대하고 있다"고 말했다.한미약품 관계자는 "BH3120 임상은 항암 치료의 패러다임을 바꾸고 있는 면역항암제 영역에서 독자적 이중항체 플랫폼 기술 '펜탐바디'를 활용하는 한미의 첫 글로벌 임상 연구 프로젝트라는 점에서 남다른 의미를 갖는다"며 "기존 치료제의 한계를 극복하고 치료 효과를 혁신적으로 높이는 차세대 면역항암제 개발을 완수할 수 있도록 연구에 더욱 매진하겠다"고 말했다.한편 KEYTRUDA®는 미국 뉴저지주 라웨이 소재 Merck & Co., Inc.의 자회사인 Merck Sharp & Dohme Corp.의 등록 상표다.