'파드셉' 요로상피암 치료제 국내+글로벌 시장 '쌍끌이'
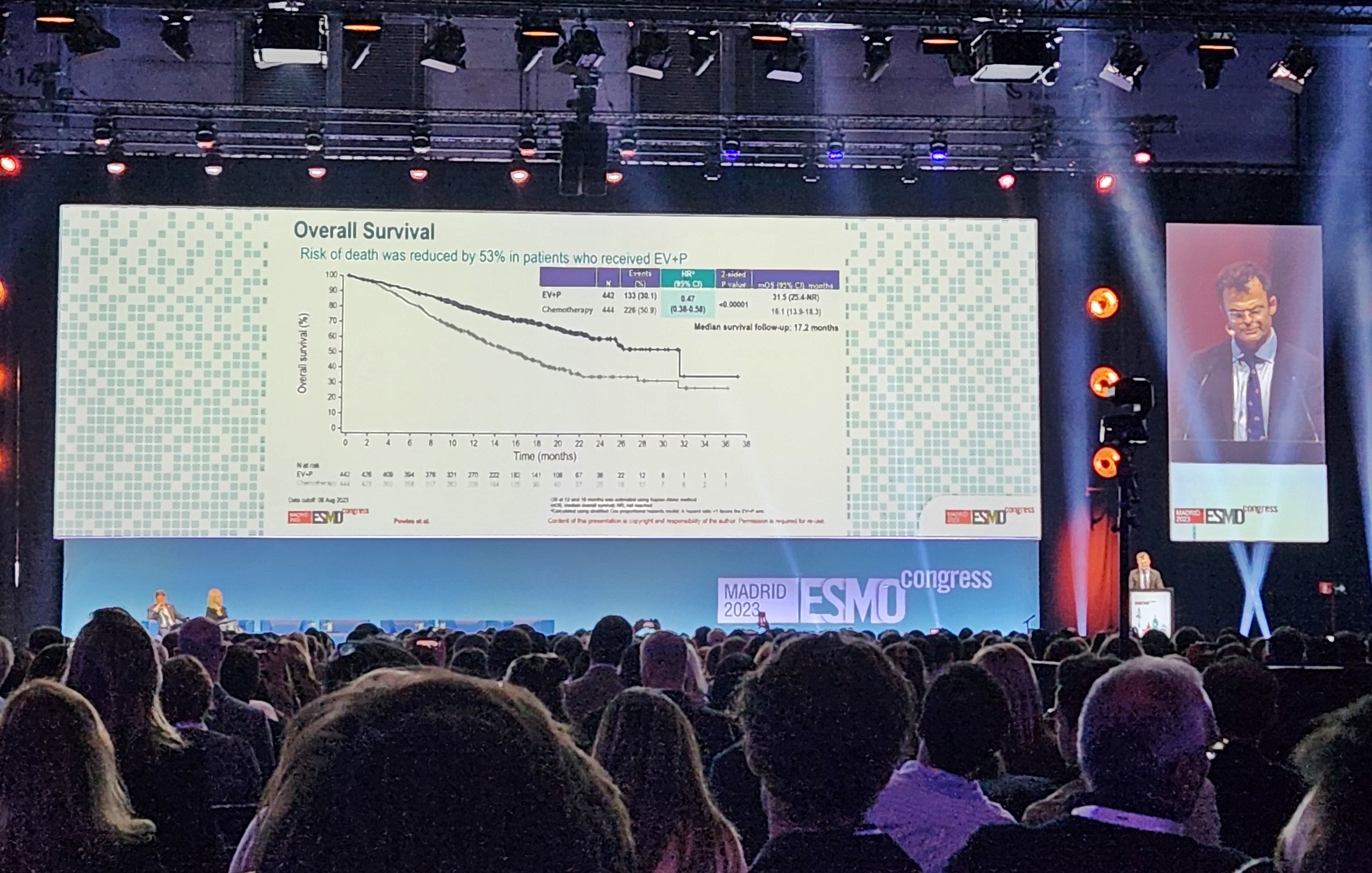
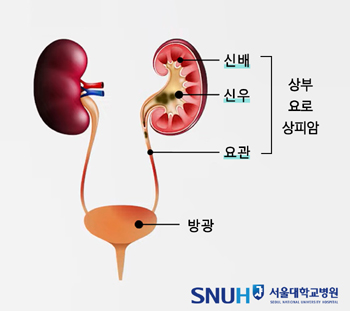
메디칼타임즈=문성호 기자아스텔라스가 화이자와 공동 개발한 항체약물접합체(ADC) '파드셉(엔포투맙 베도틴)'의 글로벌 및 국내 시장 공략을 본격화하고 있다.글로벌 시장 허가 절차와 함께 국내에서는 급여를 본격 추진하고 나선 것이다.아스텔라스 파드셉 제품사진.1일 제약업계에 따르면, 최근 건강보험심사평가원은 암질환심의위원회(이하 암질심)을 열고 파드셉의 급여기준 설정을 설정하기로 결정했다.구체적으로 파드셉은 '이전에 PD-1 또는 PD-L1 억제제 및 백금기반 화학요법제의 치료 경험이 있는 국소 진행성 또는 전이성 요로상피암 성인 환자 치료'에 급여기준 설정 필요성을 인정받았다.요로상피암의 경우 일반적으로 방광암에서 약 90%를 차지하는 질환이다. PD-L1 면역항암제 '바벤시오'가 요로상피암에 지난해부터 급여 적용되면서 파드셉은 바벤시오(아벨루맙)에 이은 2차 치료제로 급여 과정을 밟아나갈 것으로 예상된다.다만, 아직까지 약제급여평가위원회를 통한 경제성 평가와 국민건강보험공단 약가협상 과정이 남아있는 만큼 급여적용 시기는 구체적으로 특정하기에는 한계가 있다.하지만 ADC 약물로 '엔허투(트라스투주맙 데룩스테칸, 한국다이이찌산쿄)'가 정부의 혁신 신약 적정보상 지침을 적용받아 급여 논의가 진행되는 만큼 파드셉도 해당 지침에 따라 논의 될 가능성이 높다.여기에 아스텔라스는 지난해 스페인 마드리에서 열린 유럽임상종양학회 연례학술회의(ESMO Congress 2023)에 발표된 연구 결과를 바탕으로 요로상피암 1차 치료 확대를 위한 발걸음도 빨라지고 있다. 아스텔라스는 최근 유럽의약품청(EMA)에 국소 진행성 또는 전이성 요로상피암 1차 치료를 위한 '파드셉+키트루다(펨브롤리주맙) 병용요법'에 대한 허가를 신청했다고 발표했다. 미국 FDA에 이어 유럽시장도 본격적인 공략에 나선 것으로 풀이된다.다시 말해, 국내 시장에서는 2차 치료 급여를, 글로벌 시장에서는 키트루다 병용요법을 통해 1차 치료 시장 공략에 본격 나선 것이다.유럽임상종양학회 연례학술회의(ESMO Congress 2023)에서 항체약물접합체(Antibody-Drug Conjugates, ADC) 파드셉과 면역항암제 키트루다(펨브롤리주맙) 병용요법을 백금기반 항암화학요법과 비교 평가한 EV-302/KEYNOTE-A39 3상 임상 결과가 공개된 바 있다.향후 시기에 따라서는 국내 처방시장에서도 미국과 유럽에 이은 적응증 확대도 모색할 것으로 전망된다.이에 대해 서울아산병원 박인근 교수(종양내과)는 "전이성 요로상피암 치료에서 그동안 파드셉은 최후 무기로 여겨졌는데 이번 키트루다 병용요법 결과에 따라 단숨에 글로벌 시장에서 1차 치료로 앞서게 됐다. 30년만에 치료 패턴의 변화를 이끈 것"이라며 "OS 결과를 봐도 생명기간을 두 배 연장시키는 일 자체도 목격하기 힘든 드문 사례"라고 평가했다.