삼일제약-삼바에피스, 황반변성 치료제 '아필리부' 출시
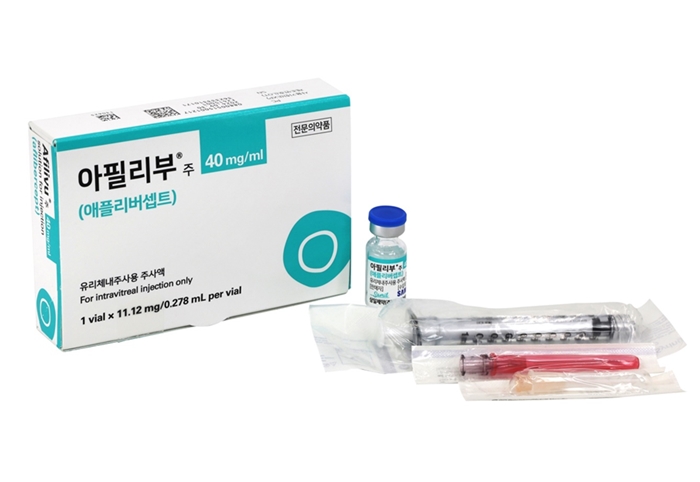
메디칼타임즈=허성규 기자삼일제약(대표이사 허승범, 김상진)은 삼성바이오에피스(대표이사 고한승)가 개발한 황반변성 치료제 아필리부(성분명 애플리버셉트)를 5월 1일자로 출시 예정이라고 29일 밝혔다.삼일제약과 삼성바이오에피스는 지난 2월 아필리부의 국내 판권에 대한 파트너십 계약을 체결한 바 있다.삼성바이오에피스가 개발해 삼일제약이 판매하게 된 아일리아의 바이오시밀러 '아필리부'가 5월 1일 출시 될 예정이다.아필리부는 혈관내피성장인자(Vascular endothelial grouth factor, VEGF)를 억제해 황반변성 등의 질환을 치료하는 anti-VEGF 계열의 약제로서, '리제네론'이 개발한 '아일리아'의 바이오시밀러이다.리제네론과 바이엘의 실적발표에 따르면 '아일리아'의 지난해 글로벌 매출 규모는 약 17조원 규모이며, IQVIA 데이터 기준 국내 매출 규모는 968억원을 기록한 블록버스터 제품이다.'아일리아' 특허 만료를 앞두고 국내외 유수의 기업들이 바이오시밀러 개발에 뛰어든 가운데 삼성바이오에피스의 아필리부가 지난 2월 최초로 국내 허가를 획득했으며, 허가 약 2개월 만에 급여 등재를 완료하는 등 출시를 위한 채비를 마쳤다.아필리부는 미국, 한국 등 10개국에서 습성 연령 관련 황반변성 환자 449명을 대상으로 아필리부(프로젝트명 SB15)의 글로벌 임상 3상을 진행 했다. 최대 교정시력 (BCVA)을 투여 시작 56주차까지 대조약(아일리아)과 유사하게 개선시켰으며, 안전성, 면역원성, 약동학적 특성 역시 오리지널(아일리아)와 유사함을 입증했다.삼일제약과 삼성바이오에피스는 지난 2022년 루센티스(성분명 라니비주맙) 바이오시밀러 '아멜리부'의 국내 판권에 대한 파트너십 계약을 체결하고 지난해 1월부터 판매 중이다.삼일제약 허승범 회장은 "삼성바이오에피스와의 연이은 파트너십 체결에 따라 아멜리부에 이어 아필리부라는 새로운 성분의 황반변성 치료제 판권을 득하게 됐다"며 "이는 대상질환을 가진 환자분들과 의료현장에서의 선택의 폭을 한층 더 넓히게 되었으며, 양사간 협력 경험을 바탕으로 시너지를 낼 것으로 기대한다"고 전했다삼일제약 이정우 부장(망막마케팅 팀장)은 "바이오시밀러의 출시는 약가 인하를 동반하기 때문에 환자의 경제적 부담을 줄이고 건강보험재정에 기여하는 측면의 의미가 크지만, 가격에 앞서 제품 개발 과정 및 품질관리에 대한 신뢰도가 선행되어야 한다"며 "아멜리부를 통해 축적된 삼성바이오에피스와 삼일제약에 대한 의료 현장의 신뢰를 아필리부를 통해서도 이어 나갈 수 있도록 하겠다"고 말했다.이번 아필리부의 출시와 관련 삼성바이오에피스 커머셜 본부장 박상진 부사장은 "아멜리부에 이어 아필리부를 삼일제약을 통해 출시함으로써 국내 안과질환 환자들에게 고품질 의약품을 활용한 치료 기회를 더 많이 제공할 수 있게 됐으며, 앞으로도 바이오시밀러 처방 확대를 통한 환자 편익을 지속 제고해 나갈 수 있도록 노력하겠다"고 전했다.