황반변성 시장 출사표 던진 국내사들…저가 정책 성공할까
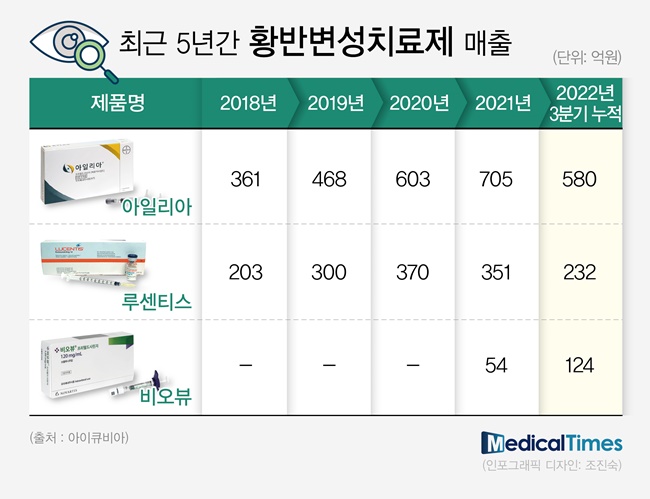
메디칼타임즈=문성호 기자한 해 1000억원 이상으로 성장한 황반변성 치료제 시장에 국내 기업들이 본격적으로 출사표를 던지고 있다.이에 대해 임상현장에서는 국산 바이오시밀러 등장을 주목하면서도 환자 투여에 대해선 신중한 반응. 가격적 장점 외에 환자 투여에 따른 임상적 효과 증명이 우선이라는 의견이 지배적이다.삼성바이오에피스 아멜리부 제품사진이다.25일 제약업계에 따르면, 종근당과 삼성바이오에피스는 루센티스(라니비주맙) 바이오시밀러로 '루센비에스'와 '아멜리부'를 각각 허가, 올해 1월 동시에 건강보험 급여로 등재하는 데 성공했다.주요 적응증인 황반변성은 눈 망막에서 빛을 받아들이는 조직인 황반이 노화와 염증으로 기능을 잃거나 심할 경우 실명에 이르게 하는 심각한 질환으로 고령화 현상에 따라 환자수가 지속적으로 증가하고 있다. 비정상적으로 생성된 혈관(신생혈관)에서 누출된 삼출물이나 혈액이 망막과 황반의 구조적 변화와 손상을 일으키는 습성 황반변성은 65세 이상 노인 인구의 3대 실명 원인 중 하나로 꼽히고 있다.현재 국내 치료제 시장의 경우 글로벌 제약사 중심으로 아일리아, 루센티스, 비오뷰 등 3개 치료제가 대다수를 차지하고 있다.의약품 조사기관 아이큐비아에 따르면, 2021년 3개 치료제를 합해 1000억원 매출 고지를 넘은 이후 2022년 3분기까지 아일리아 580억원, 루센티스 232억원, 비오뷰 124억원을 국내 병‧의원 처방시장에서 거둬들인 것으로 나타났다.아일리아와 비오뷰는 매출 면에서 성장세인 반면, 루센티스는 하락세로 돌아선 상황.익명을 요구한 서울의 상급종합병원 안과 교수는 "사실 비오뷰가 급여로 등재, 본격 출시됐을 때 미국에서 망막성혈관염 관련 안전성 문제가 제기됨에 따른 우려가 국내에서도 존재했다"며 "양날의 검인 측면이 존재했는데 긍정적인 측면으로 본다면 안전성 문제가 있었다면 처방량이 증가하지 않았을 것이다. 향후 아일리아와 본격적인 처방 경쟁이 불 붙을 것"이라고 평가했다. 이 같은 시점에서 루센티스 바이오시밀러로 종근당과 삼성바이오에피스가 올해 제품을 출시, 처방시장에서 어떤 입지를 차지할 것인지 관심이 쏠리고 있다.일단 가격적인 면에선 종근당 루센비에스는 30만원, 삼성바이오에피스 아멜리부는 46만 3773원으로 등재됐다. 오리지널인 루센티스는 현재 82만원이지만, 바이오시밀러 등재에 따라 오는 2월부터 약 58만원 수준으로 떨어질 예정이다.여기에 삼일제약은 삼성바이오에피스와 국내 유통 및 판매 계약을 맺음에 따라 본격적인 영업‧마케팅 시장에 뛰어 들었다. 현재 서울 등 대형 대학병원 약사위원회(DC)에서 해당 품목 진입 여부를 논의 중이다.다만, 임상현장에서는 가격적인 면에서 일부 환자 요구에 따라 의료진의 선택지가 될 수 있지만 오리지널도 동일하게 약가가 인하된다는 점에서 영업‧마케팅 적으로 강점이 될 수 없다는 의견이 지배적이다.가톨릭대 여의도성모병원 노영정 교수(안과)는 "급여로 등재됐지만 DC를 통과해야 하기에 국산 바이오시밀러 제품이 아직 처방시장에서 아직까지 투여는 이뤄지지 않았다"며 "국산 바이오시밀러라는 프리미엄과 함께 이들이 가격적인 장점이 존재하는 것은 분명하다. 다만, 환자 부담이 현재 10만원 정도인 루센티스도 바이오시밀러 등장에 따라 약가가 인하 될 것인데다 그동안 오리지널을 써왔다는 점에서 처방을 변경하기란 쉽지 않다"고 평가했다.결국 임상현장에서는 국산 바이오시밀러가 처방현장에서 빠르게 안착하기 위해선 가격만이 아니라 다양한 임상 데이터 확보가 중요하다고 평가했다. 해당 분야에서의 국산 바이오시밀러가 최초인 만큼 임상현장에서 처방할 수 있는 임상 근거 마련이 필수라는 뜻이다. 최근 국내 황반변성 치료제 시장에서 빠르게 안착 중인 비오뷰를 참고해야 한다는 것.노영정 교수는 "중요한 것은 바이오시밀러를 케미칼적으로 접근해 복제의약품으로 인식해서는 안 된다는 점이다. 생물학적인 제품이기에 제조 과정에서부터 철저하게 관리해야 하고, 바이오시밀러라고 해도 약품마다 품질의 차이가 존재할 수 있다"며 "가장 중요한 것은 부작용을 포함한 안전성 문제"라고 지목했다. 그는 "비오뷰가 국내 임상현장에 출시 될 당시 눈에 염증을 잘 일으킬 수 있다는 보고가 이슈였다. 현재 국내에 출시된 지 1년이 넘은 시점에서 계속 투여되고 있다는 것은 문제가 드러날 정도로 심각하지 않다는 것을 반증하기도 한다"며 "국산 바이오시밀러도 이 같은 과정을 넘어야 국내 의료진들에게 가격만이 아닌 효과와 안전성을 입증해낼 수 있을 것"이라고 덧붙였다.





