더 센 항암제가 온다...다중표적기전 처방시장 속속 진입
메디칼타임즈=원종혁 기자 다중 표적기전의 신규 항암제들이 전문약 시장에 속속 진입하면서, 처방 적응증의 영역 확대도 한결 빨라지고 있다.
난소암 분야 BRCA 변이를 타깃하는 PARP 억제제 계열 선발주자인 '린파자(올라파립)'가 최근 'HRD 양성'인 여성암종(난소암, 나팔관 및 복막암)에 1차 유지요법으로 처방 적응증을 넓힌데 이어, 하루 두 번 먹는 캡슐 형태의 'RET 변이 표적 항암제'도 본격적으로 처방권에 안착하는 것이다.
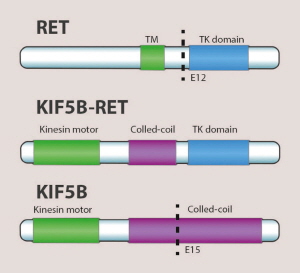
경구용 RET 표적항암제의 경우 기존 폐암 표적항암제인 EGFR 및 ALK 유전자 변이 표적항암제(TKI 제제)와는 구별되는 색다른 표적기전으로, 비소세포폐암과 갑상선암종에 적응증을 동시 허가받으면서 새로운 이정표를 세울것이란 관측도 나온다.
출처: 미국암연구소(NCI) 웹페이지.
최근 미국FDA가 표적항암제와 관련해 시판허가를 내린 리스트를 보면, 다국적제약기업인 릴리의 RET 표적항암제 '셀퍼카티닙(selpercatinib)'이 비소세포폐암과 갑상선수질암(MTC) 등에 동시 허가를 받은데 이어, 기존 허가 품목인 아스트라제네카 린파자가 HRD 양성 진행성 난소암에 '아바스틴(베바시주맙)'과 함께 쓰는 1차 유지요법으로 추가 허가를 받았다.
10일 현지시간 공개된 시판허가 상황을 보면, RET 표적항암제 셀퍼카티닙은 제품명 레테브모(Retevmo) 캡슐로 명명됐으며 RET 유전자가 돌연변이를 일으기는 고형암종에 최초 진입 품목으로 평가된다.
관전 포인트는, 해당 표적항암제가 릴리가 한화 9조 7000억원의 대규모 기업인수를 통해 확보한 신규 표적항암제였다는 대목. 릴리가 작년 항암제 전문기업인 '록소 온콜로지(Loxo Oncology)'를 80억 달러에 인수하면서 항암제 포트폴리오에 담은 신규 파이프라인이다.
이와 관련해 작년 릴리 본사는, 기존 항암제 사업부와 록소 항암제 사업부를 통합하면서 항암제 연구개발(R&D)부서를 재정비하기도 했다.
일단 허가과정을 보면 2017년 5월 셀퍼카티닙의 임상결과(당시 실험물질명 LOXO-292)가 첫 발표된 이후, 시판허가까지는 3년 남짓한 시간이 걸렸다. 올해 1월 FDA 우선심사 대상 지위를 받은 이후, 랜드마크 임상인 'LIBRETTO-001 연구' 1/2상 결과를 근거로 4개월만에 가속승인이 이뤄진 것이다. 폐암을 비롯한 갑상선암종 등 여러 암종에 동시 승인을 받은 표적항암제로는 가장 빠른 속도로 평가된다.
이번 허가 적응증을 보면, 비소세포폐암 및 12세 이상 진행성 또는 전이성 갑상선수질암으로 모두가 RET 유전자 양성을 보인 환자들이 처방 대상이다. 더불어 RET 유전자 양성인 기타 갑상선 암종의 경우에도 사용이 가능해진 것. 갑상선수질암의 경우 이전에 방사성 요오드(radioactive iodine) 치료에 불응하거나 전신 화학요법을 필요로 하는 이들도 처방 대상이다.
총 702명이 등록된 임상은 이전 치료 경험이 없는 환자와 항암화학요법을 시행한 환자들이 모두 포함됐다. 이들에 1일 2회 경구요법으로 질환 진행이나 약물 독성 문제 등이 평가됐다. 여기서 셀퍼카티닙은 항암제 효과판정의 기준으로 사용되는 주요 지표인 객관적반응률(ORR)과 반응기간(DoR)을 개선시키며 개선혜택을 입증했다.
세부적인 결과를 보면, 먼저 비소세포폐암의 경우 105명의 이전 백금계 항암화학요법을 시행한 RET 유전자 양성 환자에서 ORR은 64%로 나타났다. 더욱이 치료반응을 보인 81%의 환자에서 최소 6개월 이상 반응을 보였으며, 이전 치료경험이 없는 39명의 RET 유전자 양성 환자에서도 84%의 높은 ORR을 기록한 것이다.
143명 갑상선수질암의 경우 이전 '카보잔티닙' 및 '반데타닙' 등으로 치료경험을 가진 환자에서는 ORR이 69%였다. 이들중 76%의 환자가 최소 6개월 이상 치료반응을 유지했다. 이외 RET 유전자 양성 기타 갑상선암종에서는 이전에 방사성 요오드 불응성(radioactive iodine-refractory, RAI) 환자의 경우 ORR이 79%로 87%가 6개월 이상 치료반응을 지속했다.
안전성과 관련해서는 약물 이상반응으로 인한 치료중단율이 5%로, 가장 빈번한 중증 이상반응은 폐렴으로 나타났다.
연구팀은 "이번 결과에서 치료가 어려운 뇌전이 환자에서도 유의한 치료 반응률을 보인 것도 주목할 부분"이라며 "기존 EGFR과 ALK 유전자 변이를 표적하는 항암제 진입에 이어 RET 유전자 표적치료제 진입은 폐암 치료에 새로운 이정표가 될 것"이라고 내다봤다. 현재 두 건의 확증적 3상임상인 'LIBRETTO-431 연구' 및 'LIBRETTO-531 연구'가 환자 모집에 돌입한 상황이다.
PARP 억제제 선발 린파자 "HRD 양성 난소암 적응증 추가 확장"
사진: 린파자.
한편 같은날 아스트라제네카의 PARP 억제제 계열 표적항암제 선발품목인 '린파자(올라파립)'도 미국FDA로부터 난소암에 적응증을 추가로 확대받았다.
BRCA 변이와 무관하게 '상동재조합결핍(homologous-recombination deficiency, 이하 HRD)' 양성인 환자의 1차 치료에서 백금계 기반 항암화학요법에 완전 또는 부분반응을 보인 나팔관 또는 복막암, 상피성 난소암에 1차 유지요법으로 '아바스틴(베바시주맙)'과의 병용요법이 사용 가능해진 것이다.
이번 허가는 HRD 양성인 387명 환자를 대상으로 진행한 3상임상 'PAOLA-1 연구'의 하위분석 결과를 토대로 이뤄졌다. 주요 결과 린파자와 아바스틴 병용요법은 질환진행 또는 사망 위험을 67% 줄이는 것으로 보고했다.
이외 항암제 주요 효과판정 기준인 무진행생존기간(PFS) 비교에서도, HRD 양성 진행성 난소암 환자에서 아바스틴 단독요법을 시행한 환자군 17.7개월(중간값) 대비 린파자 병용군 37.2개월로 2배 이상의 차이를 보이며 개선혜택을 분명히 했다.