재평가로 기존 약 빼고 혁신 신약 넣고…약제비 저울질 지속
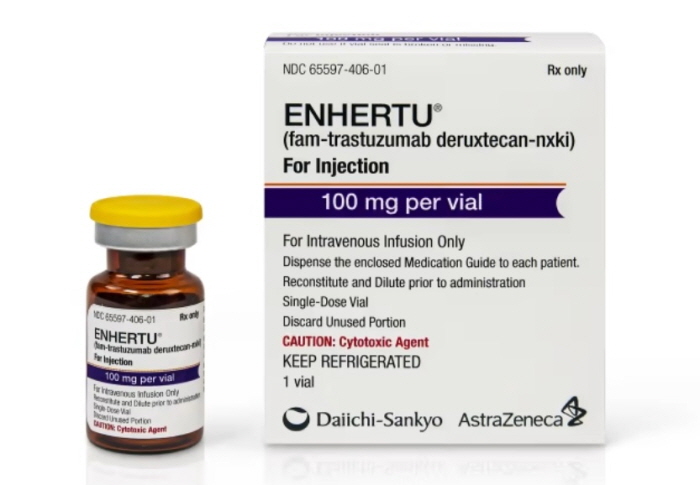
메디칼타임즈=문성호 기자2024년에도 혁신 신약을 건강보험에 넣기 위한 글로벌 제약사들의 도전이 지속될 것으로 전망된다.이를 위해 정부도 혁신 신약의 급여 등재를 위한 방안을 마련한 상태. 하지만 반대 급부로 약제비 절감 정책도 함께 추진된다.이를 통해 약제비 효율성을 유지하겠다는 의지로 대표적인 정책을 꼽는다면 혁신 신약 적정 보상 방안과 급여 재평가가 꼽힌다.정부가 혁신신약 적정 보상방안을 마련한 가운데 엔허투의 급여 적용 가능성이 주목을 받고 있다.3일 제약업계에 따르면, 보건복지부는 올해 글로벌 제약사의 고가 치료제 건강보험 급여 등재를 위해 혁신신약 적정 보상방안을 마련한 상태다.구체적으로 복지부는 건강보험심사평가원이 맡고 있는 혁신신약 경제성평가 과정에서 핵심인 ICER값 임계값을 초과해도 급여 필요성을 인정하기 위한 방안을 새롭게 마련했다.여기서 혁신성 기준은 ▲대체 가능하거나 치료적 위치가 동등한 제품 또는 치료법이 없는 경우 ▲생존기간의 상당기간 연장 등 임상적으로 의미 있는 개선이 입증된 경우 ▲식약처에서 약사법제35조의4제2항(우선 심사 대상 지정)에 해당돼 신속심사로 허가된 신약(GIFT) 또는 미국 FDA의 획기적의약품지정(BTD), 유럽 EMA의 신속심사(PRIME)로 허가된 경우다. 해당 경우에 포함되는 약제가 있을 경우 급여 등재 시 고가 치료제여도 경제성 평가를 통과할 수 있는 길이 열리게 될 전망이다. 제약업계와 임상현장에서는 정부의 혁신신약 적정 보상방안 적용 1호 약제로 유방암 치료제 엔허투(트라스투주맙·데룩스테칸, 한국다이이찌산쿄)가 대상이 될 것으로 보고 있다.혁신성 기준 중에서 '생존기간의 상당기간 연장 등 임상적으로 의미 있는 개선이 입증된 경우'에 포함될 것이란 평가다.이 가운데 복지부는 글로벌 제약사의 고가 신약 등재방안을 마련하면서도 예상되는 약제비 증가를 막기 위한 방안도 동시에 추진할 전망이다.왼쪽부터 대웅제약 가스모틴, 안플원, 삼아제약 시투스 제품사진이다. 이들 약제는 올해 급여 재평가 테이블에 오를 예정이다.대표적인 약제비 관리 방안을 꼽는다면 2021년부터 매년 실시 중인 급여 적정성 재평가다.복지부는 올해 ▲티옥트산(thioctic acid) ▲프란루카스트수화물(pranlukast hydrate) ▲이토프리드염산염(itopride hydrochloride) ▲사르포그렐레이트염산염(sarpogrelate hydrochloride) ▲레보드로프로피진(levodropropiaine) ▲모사프리드(mosapride) ▲포르모테롤 푸마르산염수화물(formoterol fumarate hydrate) 등 7개 성분을 대상으로 급여재평가를 실시할 예정이다. 이중 처방시장에서 매출액이 가장 큰 시장은 '모사프리드'와 '사르포그렐레이트' 성분이 단연 손꼽힌다. 대표 품목을 꼽는다면 두 성분 모두 대웅제약이 보유한 '가스모틴'과 '안플원'이다.여기에 프란루카스트수화물 성분 역시 관심 가는 항목으로 삼아제약 '씨투스'가 대표적이다.이들 약제의 청구금액은 한 해 4065억원 수준으로 재평가 여부에 따라 급여 퇴출이 달려있다. 해당 성분 품목을 보유한 제약사 입장에서는 한 해 수백억원의 매출을 차지하는 품목인 만큼 급여 유지에 총력을 기울일 것으로 예상된다.여기에 복지부는 올해 7개 성분의 급여재평가와 함께 추가로 2025년에 실시할 성분도 결정할 예정이다. 관심은 어떤 성분이 재평가 테이블에 오를 것 인지다. 일단 올해는 1998년부터 2001년까지 등재된 성분이 재평가 대상이 된 만큼 2025년에는 2002년부터~2005년에 등재된 성분이 될 가능성이 높은 상황. 복지부 관계자는 "현재 전체 건강보험 진료비 중 약제비가 23.3% 수준으로 25% 수준이던 5년 전과 비교해 감소 추세다. 목표는 21~22%"라며 "신약의 혁신 가치를 보상하게 되면 약제비 상승요인이 생긴다. 반면, 급여 재평가 등으로 절감하는 부분이 있는데 조화를 이뤄야지만 22% 수준으로 절감할 수 있다"고 설명했다.그는 "혁신신약을 보상하는 방안을 추진한다면 제약사가 신약을 개발하는 동기가 될 것"이라며 "동시에 신약 평가기간이 단축되면서 환자 접근성도 나아질 것으로 기대된다. 중증질환 치료제의 환자 접근성 강화도 정책의 순기능"이라고 평가했다.