부작용 관리 화두 떠오른 ADC, 폐암서 활용 제한되나
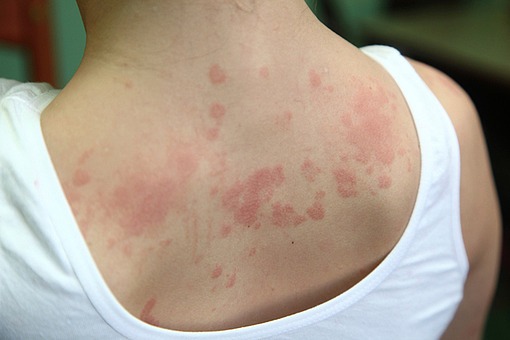
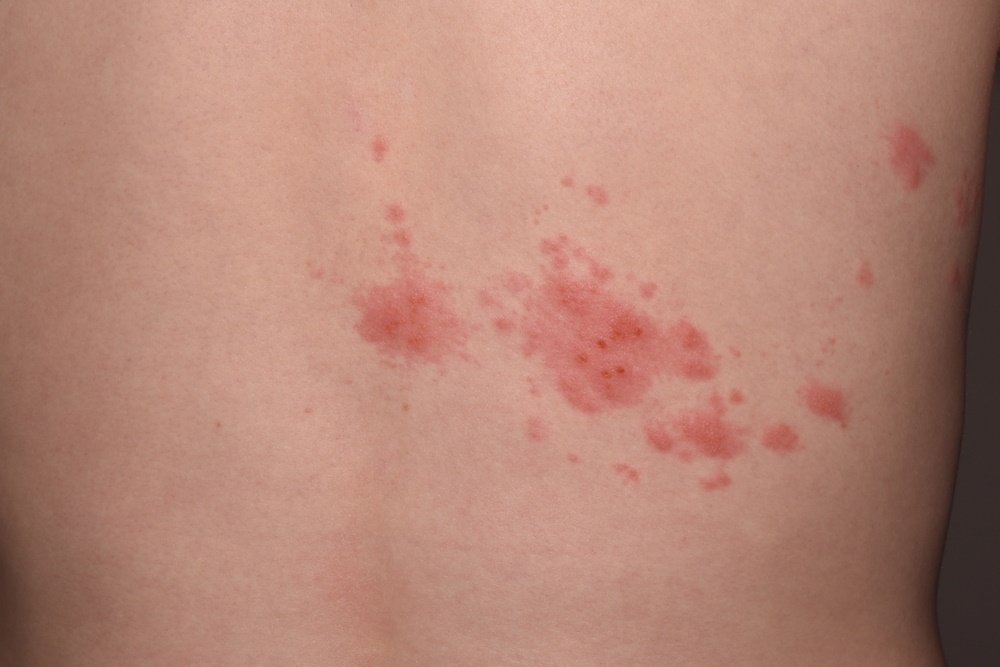
메디칼타임즈=문성호 기자폐암 분야에서 글로벌 시장을 선점하기 위한 항체약물접합체(Antibody Drug Conjugate, ADC) 경쟁이 가속화되고 있다.하지만 정작 의학계에서는 폐암 분야서 ADC 활용을 위해선 이상반응 관리가 중요하다는 평가다.2024년 유럽폐암학회 포스터 전시 세션 모습이다. (자료 출처 : ELCC 2024)지난 20일(현지시간) 23일까지 체코 프라하에서 열린 유럽폐암학회 연례학술회의(ELCC 2024)에서는 ADC 활용의 과제로 이상반응 관리가 화두로 제시됐다.현재 비소세포폐암(Non-small Cell Lung Cancer, NSCLC)에서의 대표적인 ADC 치료제로서 주목받는 것은 아스트라제네카와 다이이찌산쿄가 공동 개발 중인 다토포타맙 데룩스테칸(Dato-DXd)이다.테트라펩타이드 기반 링커를 통해 항-TROP2 인간화 IgG1 단일클론항체와 토포아이소머라제 I 억제제 페이로드(엑사테칸 유도체, DXd)를 연결했다.지난해 유럽임상종양학회 연례학술회의(ESMO Congress 2023)에서 공개한 TROPION-LUNG01 임상 3상을 토대로 '전신 치료를 받은 적이 있는 국소 진행성 또는 전이성 비편평 비소세포폐암(NSCLC) 치료제'로 FDA에 바이오의약품 품목허가신청(Biologics License Application, BLA)을 한 상태다.여기에 또 하나의 후보는 머크와 다이이찌산쿄가 공동개발 중인 '파트리투맙 데룩스테칸(HER3-DXd, patritumab deruxtecan)'이다. 현재 FDA 우선 심사 대상으로 지정되면서 향후 치료 옵션으로 주목하고 있다.이 가운데 ELCC 2024에서는 이 같은 Dato-DXd, HER3-DXd를 주목했다. 다만, 치료효과보다는 이상반응이 주요 논의의 주제로 부상했다. 이상반응을 고려해 해당 약물의 치료 대상을 식별하는 것이 중요하다는 뜻이다.다시 말해, 폐암에서의 ADC 활용에 있어 효과도 중요하지만 독성관리에 대한 균형을 맞춰야 한다는 의견이다.RCSI(Royal College of Surgeons in Ireland) 보건대 보몬트 병원 Jarushka Naidoo 교수는 "TROPION-LUNG01에서 3등급 이상의 치료 관련 부작용(AE)은 도세탁셀보다 Dato-DXd에서 적게 발생했지만, 임상시험 전체 NSCLC 환자를 대상으로 봤을 때 22%의 비율이 여전히 높다"고 관리 필요성을 시사했다.이어 Jarushka Naidoo 교수는 "HER3-DXd의 경우 6개월의 추가 추적 관찰 결과, 환자의 65.3%는 주로 혈액학적 3등급 이상의 이상반응이 발생했고, 6.2%의 환자는 간질성 폐질환이 발생했다"며 "대상자가 사전 치료를 받은 환자이기에 내약성이 매우 중요하지만 투약군의 2/3의 환자가 최소 3등급 부작용을 경험했다"고 평가했다.