기대 모으는 크리스탈지노믹스 췌장암 신약 경쟁력은?
메디칼타임즈=최선 기자 유명인들이 췌장암으로 사망하는 사례가 지속되면서 췌장암 정복을 위한 유망 약물 후보군들이 재차 거론되고 있다.
예후가 나쁜 췌장암의 특성상 기존 1차 치료제 대비 경쟁력 있는 임상적 유효성, 안전성을 확인하는 것이 관건.
크리스탈지노믹스가 개발중인 췌장암 신약 아이발티노스타트의 경우 기존 1차 치료제 대비 임상적 유효성과 안전성을 확보해 3상 진입 및 그 결과에 관심이 고조되고 있다.
크리스탈지노믹스의 췌장암 신약에 대한 기대가 커지고 있다.
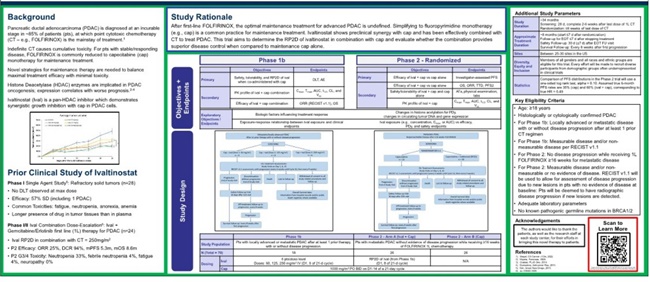
지난 3월 크리스탈지노믹스는 췌장암 1차 치료제로 개발 중인 '아이발티노스타트(Ivaltinostat)'의 임상 3상 시험을 위한 시험계획서(IND)의 승인을 식품의약품안전처에 신청한 바 있다.
아이발티노스타트는 Class I, Class IIb HDAC 만을 강하게 억제하는 우수한 효능이 있다. 또한 이 외 다른 단백질들을 억제하지 않으므로 기존의 췌장암 치료제와는 다르게 정상 세포에서의 심각한 부작용은 예상되지 않는다.
비임상 시험 결과, 아이발티노스타트가 췌장에서 혈액 대비 10배 이상 높게 검출됨에 따라 췌장에서의 치료 효과가 가장 우수할 것으로 예측했고 췌장암 치료제로의 개발이 가장 유망하다는 평가를 받았다.
면역반응은 면역활성과 면역억제 균형에 의해 결정된다. 아이발티노스타트는 면역활성 유도 세포인 Cytotoxic T 세포와 NK 세포의 활성을 촉진함과 동시에 면역억제 세포인 M2 대식세포와 MDSC 분화를 억제해 항종양 면역 활성 반응을 극대화한다.
실제로 사람 또는 마우스 면역세포를 이용한 실험을 통해 극대화된 항종양 면역 활성 반응을 확인했고 논문으로도 보고한 바 있다.
실제로 아이발티노스타트는 기존 1차 치료제 대비 경쟁력 있는 임상적 유효성을 확인했다.
비임상 시험 결과를 바탕으로 아이발티노스타트의 임상적 유효성을 극대화하기 위한 임상 병용 약물로 젬시타빈+엘로티닙을 선정했다.
진행성 또는 전이성 췌장암 임상 1/2상 시험에서 아이발티노스타트+젬시타빈+엘로티닙 요법의 유효성은 전체 분석군(FAS) 16명에서 부분관해 4명(25%), 안전병변 11명(68.8%), 진행병변 1명(6.3%)으로 나타났다.
전체 분석군의 질병통제율(DCR)은 93.8%, 객관적반응률(ORR)은 25%로 확인됐다. 전체분석군 중, 임상시험에서 목표했던 6주기의 약물 투약을 완료한 군(PP) 10명의 종양평가 결과는 부분관해 3명(30%), 안전병변 7명(70%)이었고, 진행병변은 없었다.
따라서 질병통제율은 100%로 10명 모두 약물에 의한 효과를 봤다.
진행성 및 전이성 췌장암에 대한 기존 요법은 젬시타빈+엘로티닙 병용요법, 젬시타빈과 Nab-파클리탁셀 병용 요법 및 폴피리녹스 요법이 있다.
아이발티노스타트+젬시타빈+엘로티닙 3제 병용 요법은 모든 유효성 평가지표에서 젬시타빈+엘로티닙 병용 요법 대비 현저히 우수한 결과를 나타냈다.
다수의 논문으로 보고된 임상결과 대비 질병통제율의 경우 약 1.7배, 무진행생존율의 중앙값(median PFS)의 경우 약 1.7배 개선됐다.
특히 6주기의 약물 투약을 완료한 군의 객관적반응률, 1년 생존율, 전체생존율의 중앙값은 각각 2.2, 1.8, 그리고 1.6배가량 개선됐다.
임상적 안전성 부분 역시 잠재력을 가진 것으로 확인됐다.
아이발티노스타트 3제 병용 요법에서는 3등급 이상의 말초신경병증이 나타나지 않았다. 다른 3~4등급에 해당하는 심각한 이상반응의 발생 빈도도 현저히 낮았으며, 1차 치료제인 폴피리녹스 요법과 젬시타빈+Nab-파클리탁셀 요법 대비 안전성을 현저히 개선시켰다.
크리스탈지노믹스는 아이발티노스타트를 췌장암 1차 치료제로 승인받기 위해 임상 3상 시험 신청서를 제출한 상태다. 총 170명 대상의 임상 3상 시험을 통해 폴피리녹스 요법 대비 경쟁력 있는 유효성과 현저히 개선된 안전성을 다시 한번 입증한다면 1차 치료제로 승인 가능하다.
또한 췌장암 적응증에 대한 자신감을 바탕으로 미국 임상 2상 시험도 준비 중이다. 아이발티노스타트는 이미 FDA로부터 췌장암, 간암, 급성골수성백혈병 대상 희귀의약품으로 지정 받은 바 있다.