올초 10년만에 후발주자 진입으로 주목
경동제약 이어 라이트팜텍, 명문제약도 도전장
올해 초 10년만에 후발주자들의 진입이 이어졌던 나프록센+에스오메프라졸(NSIADs+PPI) 복합제 시장에 추가 도전자들의 합류가 이어질 전망이다.
이는 시장 규모가 탄탄한 반면 여전히 경쟁자가 적다는 점에서 시장성이 있다고 판단한 것으로 풀이된다.
13일 식품의약품안전처 임상시험정보 등에 따르면 명문제약은 건강한 성인 자원자를 대상으로 'MMP-114'와 'MMP-1141'의 생물학적 동등성 및 안전성 평가를 위한 시험을 승인 받았다.
해당 생동의 대상이 되는 의약품은 에스오메프라졸과 나프록센 성분의 복합제다.
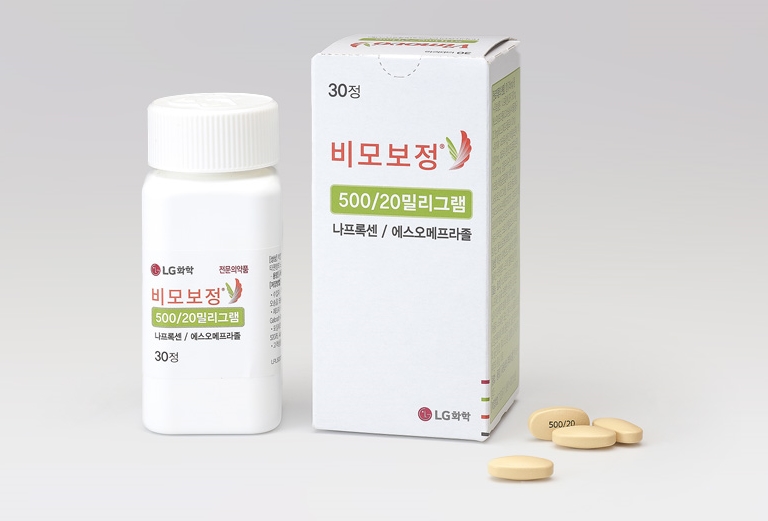
이는 LG화학의 '비모보정'이 오리지널 의약품으로 지난 2012년 국내 허가를 획득한 품목이다.
비모보정은 허가된 효능‧효과는 비스테로이드성 소염진통제(나프록센 등)와 관련한 위궤양 및/또는 십이지장궤양의 발생 위험이 있으면서 저용량 나프록센 또는 다른 비스테로이드성 소염진통제에 의해 충분하지 않은 환자에서의 골관절염, 류마티스성 관절염, 강직성척추염의 증상 치료다.
이는 NSAIDs 제제 복용 시 속쓰림과 같은 위장관계 부작용이 흔히 발생한다는 점에서 착안해 개발된 것.
특히 해당 품목의 경우 허가 이후 2014년까지 한미약품 등의 제네릭 허가가 이어졌고, 꾸준한 성장 곡선을 그려왔다.
이에 최근 경동제약을 시작으로 약 10년만에 후발주자들이 진입하며 해당 시장에 대한 도전에 나서는 상황.
경동제약에서 생산하는 동국제약, 마더스제약, 제뉴원사이언스의 품목도 허가를 받아 최근 급여권에 진입했다.
이런상황에서 명문제약 역시 해당 품목 개발에 뛰어들면서 향후 제네릭 시장 경쟁 확대를 예고한 것.
여기에 아직 허가 받지 않았으나 라이트팜텍이 앞서 생동을 승인 받았다는 점에서 추가적인 경쟁자 합류는 더욱 늘어날 가능성이 남아있다.
결국 이처럼 국내사들의 도전이 이어지는 것은 여전히 해당 복합제에 대한 시장성이 있다는 판단 때문으로 분석된다.
실제로 해당 복합제 시장은 제네릭 포함 7개 품목 뿐인 지난 2023년 기준 약 628억원 수준이었다.
이에 4개 품목이 추가됐음에도 여전히 경쟁이 치열하지 않아, 시장성이 있다고 판단한 것으로 풀이된다.
이에 추가적인 경쟁자의 합류가 이어질지는 물론, 제네릭의 추가 진입으로 시장이 어떻게 변화할지에 관심이 주목된다.