FDA, 레켐비 가송승인…주요 임상 무난한 합격점
부작용 관련 이슈가 주요 관건…비용 장벽도 여전
바이오젠과 에자이의 두 번째 알츠하이머 치료 신약 '레켐비(성분명 레카네맙)'가 수많은 논란으로 얼룩진 아두헬름(성분명 아두카누맙)의 그늘을 지울 수 있을까?
부작용에 대한 이슈가 여전히 남아있지만 현재까지 임상 현장에서 내린 평가는 긍정적이다. 향후 국내에 도입된다면 초기 알츠하이머 환자에게 권할 것이라는 게 전문가의 시각이다.
지난 6일(현지시간) 미국 식품의약국(FDA) 초기 알츠하이머 치료제 레켐비를 가속 승인(accelerated approval) 했다고 발표했다.
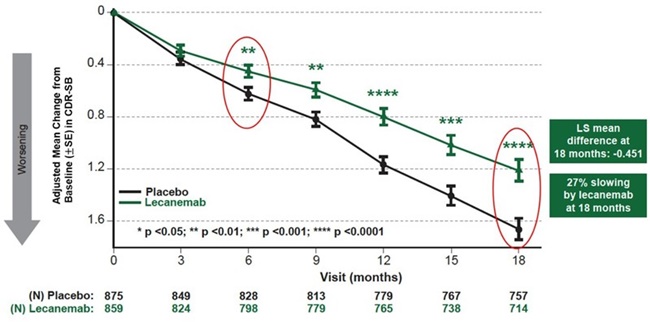
이번 승인은 초기 알츠하이머병을 지닌 50~90세 환자 1795명을 대상으로 레카네맙과 위약을 비교연구한 Clarity AD 3상 연구를 바탕으로 이뤄졌다.
연구에 따르면 레켐비는 18개월 시점에서 임상치매평가척도(CDR-SB) 점수가 1.21을 기록해 위약 1.66 대비 기능 저하 속도를 27% 지연시켰다. 지연 효과는 빠르면 6개월 시점부터 나타났다.
주요 2차변수에서도 위약 대비 통계적으로 유의미한 결과를 얻었다. 아밀로이드 PET 하위 연구에서 레카네맙군은 3개월 시점부터 뇌 아밀로이드 축적이 통계적으로 유의하게 감소했다.
상급종합병원 신경과 A교수는 "알츠하이머 질환을 가지고 있는 젊은 환자이고 향후 치매가 진행될 것 같은 사람에게는 도움이 될 것으로 보고있다"며 "의사로서 환자에게 당연히 추천할 것 같다"고 말했다.
이어 그는 "다만 식품의약품안전처의 허가와 더불어 비용적인 문제 등 국내 상황을 지켜봐야할 필요성은 있다"며 "이와 별개로 치료를 원하는 환자가 있다면 선택하지 않을 이유가 없다"고 밝혔다.
특히, 전문가들이 레켐비를 아두헬름과 다른 선상에 두고 있는 이유는 임상 설계와 결과면에서 의문 부호를 해소했기 때문이다.
이에 대해 대한치매학회 양동원 이사장은 "같은 아밀로드 베타 기전의 약물인 아두헬름 임상은 중간 분석 단계에서 중단됐다가 용량을 바꿔 추가 진행하는 등 우여곡절이 많았다"며 "반면 레카네맙은 같은 기전의 약물로 깔끔하게 임상을 마무리했고 기존 약제 대비 효과면에서 앞섰기 때문에 더할 나위 없는 결과"라고 설명한 바 있다.
레카네맙의 임상에 참여중인 서울 상급종합병원 신경과 B교수는 "치료제의 효과성을 볼 때 아밀로이드 베타가 얼마나 감소하는지(wash out) 여부와 임상적 유지되는지가 중요했지만 아두헬름의 경우 임상적 부분에 있어서 추가적인 통계 과정이 있어야 했다"며 "레켐비의 경우 이러한 부분 없이 아미로이드 베타를 감소하는 바이오마커와 임상적 효과 모두 만족됐다"고 밝혔다.
다만 레켐비에도 변수는 존재한다. 레켐비는 현재 뇌부종과 출혈을 동반하는 아밀로이드 관련 영상 이상(ARIA)에 대한 안전성 이슈가 존재하며 처방 정보에도 이에 대한 부작용 경고가 포함됐다.
B 교수는 "다발성 뇌출혈이나 뇌졸중의 경우 사망까지 이어진 만큼 주요 리스크지만 특정 ApoE 유전자를 가진 환자에서 ARIA가 더 발생하는 현상 있어 추가 데이터 분석이 있어야할 것으로 본다"고 언급했다.
아두헬름보다 낮지만 여전히 비싼 레켐비…가격 허들 문제는?
바이오젠과 에자이는 레켐비가 임상적으로 우수한 성과를 거둔 만큼 아두헬름의 실패를 뒤집기 위해서라도 상용화 안착에 매진한다는 계획이다.
문제는 여전히 비용측면에서 넘어야할 심리적 장벽이 존재한다는 점이다.
에자이에 따르면 레켐비의 가격은 연간 2만6500달러(약 3400만원)로 아두헬름의 5만6000달러의 거의 절반 수준이지만 여전히 부담스러운 가격이라는 평가다.
이와 관련해 에자이는 "레켐비 치료로 기대할 수 있는 환자 당 연간 가치를 3만7600달러로 추정하지만 이보다 낮은 2만 6500달러로 책정하기로 결정했다"고 밝혔다.
그러나 미국 공공의료보험인 메디케어·메디케이드서비스센터(CMS)가 아두헬름 임상에 참여한 환자 외에는 보험 급여를 제한한 것은 물론 항아밀로이드 항체에 대해 보장범위를 제한했다는 점에서 즉각적인 매출 성과를 거두기 어려운 상태다.
미국 에자이의 이반 청 CEO "메디케어 환자들은 당분간 에자이와 바이오젠의 신약에 접근할 수 없고 이 기간 동안 매출이나 수요 창출을 기대하기 어려울 것"에자이의 계획은 레켐비의 완전 승인을 신청하는 것이다"고 전했다.
즉, 레켐비가 CMS의 보장을 받기 위해서는 가속승인을 넘어 완전승인을 받아 항아밀로이드 항체의 메디케어 적용을 제한하는 미국 국가단위의 급여결정 절차인 국가보장결정(NCD)의 허들을 넘어야 한다는 의미다.
이 같은 이유로 바이오젠과 에자이는 레켐비 정식 허가를 위해 조건부 허가가 내려진 날 FDA에 추가 생물의약품 허가 신청서(sBLA)를 제출한 상태다.
이반 청 CEO는 "레켐비 출시와 관련해 단계접근을 계획하고 있으며 본질적으로는 완전승인을 통해 미국 전역 의료 시스템에 공급하는데 초점을 맞추고 있다"고 덧붙였다.