신물질 신약 22개‧바이오신약 15개 허가
2022년 신약 최대 기대주 릴리 마운자로
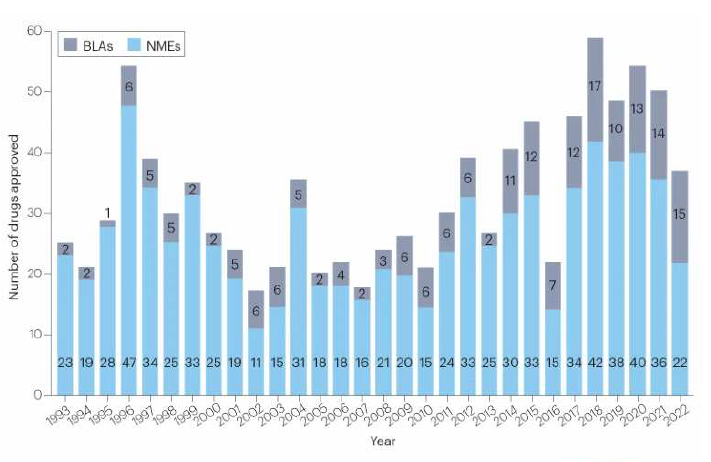
2022년 미국 식품의약국(FDA)가 37개의 신약을 허가하면서 6년 만에 최저치를 기록했다.
특히, 6월 중순부터 8월 중순까지 약 2달여의 기간 동안 한 개의 신약도 승인하지 않은 구간도 있었던 상황. 일부에서는 신약 승인 감소가 아두헬름 허가의 여파라는 시각도 나오는 모습이다.

2022년 한해 FDA 약품평가연구센터(CDER)는 신물질신약(NME) 22개, 바이오신약(BLA) 15개 등 총 37개 신약을 허가해 6년 만에 최저치를 기록했다.
다만, 신약(Novel Drug)에는 바이오의약품평가연구센터(CBER)가 담당하는 백신, 세포 및 유전자치료제, 혈액제제 등은 포함되지 않는다.
2022년에 CBER는 백신 2개, 세포․유전자치료제 5개, 마이크로바이옴치료제 1개 등 총 8개의 바이오의약품에 대해 정식 허가를, 코로나19 백신 및 치료제 각각 1개를 긴급사용승인했다. 두 센터가 허가한 신약의 수를 합치면 45개로 허가 숫자가 증가한다.
37개 허가 신약을 적응증별로 살펴보면 항암제는 CDER 승인 목록에서 계속해서 우세해 전체 신약 37개 중 10개인 27%로 가장 큰 비중을 차지했다.
또 피부질환(Dermatology) 및 혈액질환(Haematology) 적응증 승인 건수는 지난 5년 평균보다 증가했지만, 감염성 질환(Infectious Disease) 및 신경과질환(Neurology)은 감소하는 추세를 보였다.
37개 허가 신약을 세분화해 보면 저분자신약이 21개, 바이오신약이 15개, 올리고뉴클레오타이드가 1개로 올리고뉴클레오타이드는 1개의 siRNA(small interfering RNA)치료제이다.
저분자신약은 살펴보면 18개의 비펩타이드성 저분자신약과, 2개의 펩타이드성 저분자신약, 1개의 방사선의약품이 포함됐다.
아울러 바이오신약은 6개의 단일클론항체(mAb), 4개의 이중특이항체(Bi-specific), 2개의 효소치료제, 1개의 항체-약물 접합체(ADC), 융합단백질 및 기타로 분류된 의약품 각각 1개 등 총 15개로 2018년 이후 가장 높은 수치를 기록했다.
CDER에서 허가한 37개 중에는 BMS가 개발한 3개의 신약이 포함돼 있으며, CBER에서 허가한 8개 중에는 블루버드 바이오가 개발한 2개의 유전자치료제(Skysona, Zynteglo)가 포함돼 이들 기업이 20222년 최대 수혜 기업으로 꼽혔다.
다만, 6년만에 FDA가 신약 승인 최저치를 기록한 것은 2021년 허가 당시 논란이 됐던 알츠하이머 치료제 아두헬름의 영향이라는 의견도 존재하는 상황.
실제 지난 달 29일 미국 미 하원 감독개혁위원회와 에너지·상업위원회는 아두헬름 승인에 대해 조사 결과를 담은 최종보고서를 발표했다.
보고서는 아두헬름 승인과 관련해 FDA와 바이오젠의 논의과정은 기존의 관행을 벗어나 있었다고 지적했으며, 높게 책정된 가격에 대한 부분을 비판했다.
이와 함께 보고서에는 FDA 자문위원회 심사위원 11명 전원이 승인에 반대했지만 결국 FDA는 승인했다는 점도 언급됐다.
또 FDA가 지난 6월 중순부터 8월 중순까지 2달간 한 개의 신약도 승인하지 않았다는 점도 의문부호가 붙어있다. 2021년의 경우 같은 기간 8개의 신약이 승인됐다.
특히, 지난해 12월 5개의 신약의 승인을 이뤄지지 않았다면 37개보다 더 적은 신약 승인이 이뤄졌을 것이란 시각이다.
이와 별개로 37개 허가 신약 중 향후 메가 블록버스터 의약품이 될 것으로 가장 주목받고 있는 릴리의 마운자로(성분명 티제파티드)다.
마운자로는 제2형 당뇨병 환자의 혈당 수치를 조절하기 위한 GLP-1과 또 다른 호르몬인 GIP에 이중 작용하는 약물로 GLP-1과 함께 사용하는 경우 혈당과 체중을 낮추는 효과가 확인돼, 지난해 5월 당뇨병 치료제로 FDA 허가를 받았다.
이 밖에도 마운자로는 비만치료제로도 임상3 상을 진행하고 있어 2023년에 허가를 받을 것으로 전망되고 있다.
시장조사기관 리서치앤드리서치(Research and Research) 자료에 따르면, 세계 비만치료제 시장 규모는 2021년 32억달러(약4조630억원)에서 2026년 46억 달러(5조8406억원)로 성장할 것으로 전망되고 있다.
현재 마운자로는 이미 오프라벨로 비만치료제 사용되는 상황으로 향후 비만체료제로 허가받을 경우 노보노디스크의 위고비 및 삭센다와 경쟁이 예상된다.