식약처 7~8년전 수술 여성 최근 역형성 대세포 림프종으로 최종 진단
8월부터 부작용 위한 환자 등록 연구 시행...학회 "유방변화시 검사 받을 것"
최근 인공유방의 역형성 대세포 림프종(Anaplastic Large Cell Lymphoma, BIA-ALCL) 발생 가능성과 관련해 제품 회수가 실시된 가운데 실제 BIA-ALCL 환자 사례가 보고됐다.
예방 차원에서 제품이 회수됐지만 환자 사례가 보고된 만큼 의심 증상이 나타날 경우 지체없이 의료기관 방문이 필요하다는 게 전문가들의 제안이다.
16일 식품의약품안전처와 대한성형외과학회는 국내에서 유방 보형물 연관 BIA-ALCL 환자가 보고됐다고 밝혔다.
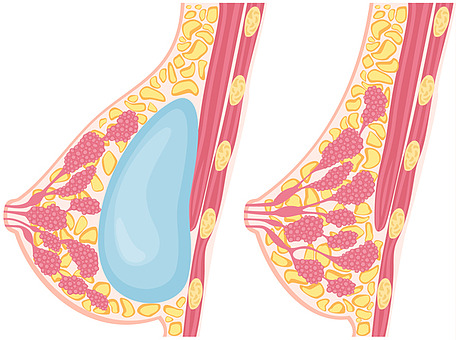
BIA-ALCL은 면역체계와 관련된 희귀 암의 한 종류로 유방암과는 별개의 질환이다. 의심 증상으로는 조직액이 특정 장소에 고여서 덩어리처럼 만져지는 장액종과, 장액종으로 인한 유방 크기 변화, 피막에 발생한 덩어리나 피부 발진 등이 있다.
해당 환자는 40대 여성으로 약 7~8년 전 유방 보형물 확대술을 받았는데, 최근 한 쪽 가슴에 붓기가 심하게 발생해 성형외과 의원을 방문했다가 BIA-ALCL 의심 하에 모 대학병원으로 옮겨졌다. 이후 최종 진단을 받고 대한성형외과학회 및 식약처에 14일 보고됐다.
이에 지난 15일 전문가 등 관계자 회의를 개최해 엘러간사 거친 표면 유방 보형물을 이식한 환자에게서 BIA-ALCL이 발생했음을 최종 확인했다.
식약처는 수입‧제조업체와 함께 부작용 발생으로 인한 치료비 보상 등에 대한 대책 등을 수립하고 있으며, 유방 보형물 부작용 조사 등 환자 등록연구를 통해 안전관리에 만전을 기할 것이라고 했다.
대한성형외과학회는 갑작스러운 유방 모양의 변화나 덩어리, 피부 발진 등 의심 증상이 발생하는 경우에는 반드시 전문 의료 기관을 방문할 것을 권장했다.
다만 미국, EU 등 선진국에서도 BIA-ALCL 발생위험이 낮고, 제거수술 관련 마취, 수술 후 혈종, 염증, 감염 등 위험성을 고려할 때 증상이 없는 환자의 경우 예방 목적의 보형물 제거는 권장하지는 않았다.
자진 회수 중인 엘러간 사의 인공유방은 2007년 허가 이후 약 11만개가 수입됐으며, 최근 3년간 약 2만 9천개가 유통된 것으로 파악하고 있다.
식약처는 인공유방 환자에 대해 부작용 발생시 환자의 건강 상태를 지속적으로 점검할 수 있도록 인공유방의 부작용 조사를 위한 환자 등록 연구를 8월부터 실시할 예정이다.
예방 차원에서 제품이 회수됐지만 환자 사례가 보고된 만큼 의심 증상이 나타날 경우 지체없이 의료기관 방문이 필요하다는 게 전문가들의 제안이다.
16일 식품의약품안전처와 대한성형외과학회는 국내에서 유방 보형물 연관 BIA-ALCL 환자가 보고됐다고 밝혔다.

해당 환자는 40대 여성으로 약 7~8년 전 유방 보형물 확대술을 받았는데, 최근 한 쪽 가슴에 붓기가 심하게 발생해 성형외과 의원을 방문했다가 BIA-ALCL 의심 하에 모 대학병원으로 옮겨졌다. 이후 최종 진단을 받고 대한성형외과학회 및 식약처에 14일 보고됐다.
이에 지난 15일 전문가 등 관계자 회의를 개최해 엘러간사 거친 표면 유방 보형물을 이식한 환자에게서 BIA-ALCL이 발생했음을 최종 확인했다.
식약처는 수입‧제조업체와 함께 부작용 발생으로 인한 치료비 보상 등에 대한 대책 등을 수립하고 있으며, 유방 보형물 부작용 조사 등 환자 등록연구를 통해 안전관리에 만전을 기할 것이라고 했다.
대한성형외과학회는 갑작스러운 유방 모양의 변화나 덩어리, 피부 발진 등 의심 증상이 발생하는 경우에는 반드시 전문 의료 기관을 방문할 것을 권장했다.
다만 미국, EU 등 선진국에서도 BIA-ALCL 발생위험이 낮고, 제거수술 관련 마취, 수술 후 혈종, 염증, 감염 등 위험성을 고려할 때 증상이 없는 환자의 경우 예방 목적의 보형물 제거는 권장하지는 않았다.
자진 회수 중인 엘러간 사의 인공유방은 2007년 허가 이후 약 11만개가 수입됐으며, 최근 3년간 약 2만 9천개가 유통된 것으로 파악하고 있다.
식약처는 인공유방 환자에 대해 부작용 발생시 환자의 건강 상태를 지속적으로 점검할 수 있도록 인공유방의 부작용 조사를 위한 환자 등록 연구를 8월부터 실시할 예정이다.