로그인
 로그인을 하시면 메디칼타임즈의
로그인을 하시면 메디칼타임즈의다양한 연관서비스를 이용하실 수 있습니다. 가입 시 등록한 정보를 입력해주세요.
 개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.
개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.안전한 개인정보 보호를 위해 3개월마다 비밀번호를 변경해주세요. ※ 비밀번호는 마이페이지에서도 변경 가능합니다.
30일간 보이지 않기
- 제약·바이오
- 국내사
신약 개발 지원 수혜…FDA 신약 승인 역대 최다
발행날짜: 2019-02-07 12:09:13
-
가
-
59건중 34건 희귀질환 신약 차지…희귀질환 치료제·획기적 치료제 지정·우선 심사 등 지원 제도 뒷받침
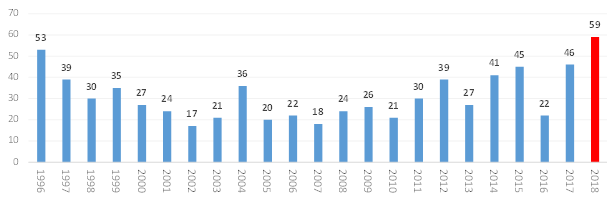
지난해 미국 식품의약국(FDA)의 신약 허가건수가 역대 최다인 59건을 기록했다.
희귀의약품 지정 등 신속심사 및 허가제도의 활용으로 승인건수가 크게 증가한 것으로 분석된다.
7일 생명공학정책연구센터는 FDA CDER(의약품평가연구센터) 자료를 인용, 이같이 밝혔다.
이에 따르면 2018년 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 1996년 53건 보다 6건이 많은 승인건수로 최고기록을 경신했다.
미국 FDA 신약 승인 현황(1996~2018) 및 신약 종류별 승인 현황(2008~2018)
미국 FDA의 신약 허가건수는 트럼프 정부 출범 이후 추진된 규제완화 정책으로 신약 승인이 가속화돼 2016년 22건에서 2017년 46건, 2018년 59건을 기록했다.
이는 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지하고 있다.
59건중 34건이 구루병, 파브리(Fabry) 질환, 페닐케톤뇨증(phenylketonuria) 치료제 등 희귀질환 환자 치료관련 신약이 차지했다.
승인 건수의 증가는 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약 개발 지원 제도가 뒷받침된 것으로 분석된다.
FDA 의약품평가연구센터는 신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공해 환자 치료 및 국민 건강 향상에 기여한 것으로 평가했다.
또한 희귀질환 및 전염병 등 공공성 및 미충족 욕구가 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
승인된 신약을 유형별로 보면 59건의 신약 중 32%인 19개가 First-in-class(혁신신약)로 승인됐다.
또 58%인 34개는 희귀질환(Rare Diseases) 치료제로, 73%인 43개는 하나 이상의 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)를 통해 승인받았다.
59건 중 24건은 신속심사(Fast Track)로, 14건은 획기적치료(Breakthrough therapies)로, 43건은 우선심사(Priority Review) 대상으로 지정, 4건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
또 59건 중 71%인 42건은 다른 국가에서 승인받기 전에 미국에서 최초로 승인된 약물이다.
희귀의약품 지정 등 신속심사 및 허가제도의 활용으로 승인건수가 크게 증가한 것으로 분석된다.
7일 생명공학정책연구센터는 FDA CDER(의약품평가연구센터) 자료를 인용, 이같이 밝혔다.
이에 따르면 2018년 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 1996년 53건 보다 6건이 많은 승인건수로 최고기록을 경신했다.

이는 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지하고 있다.
59건중 34건이 구루병, 파브리(Fabry) 질환, 페닐케톤뇨증(phenylketonuria) 치료제 등 희귀질환 환자 치료관련 신약이 차지했다.
승인 건수의 증가는 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약 개발 지원 제도가 뒷받침된 것으로 분석된다.
FDA 의약품평가연구센터는 신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공해 환자 치료 및 국민 건강 향상에 기여한 것으로 평가했다.
또한 희귀질환 및 전염병 등 공공성 및 미충족 욕구가 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
승인된 신약을 유형별로 보면 59건의 신약 중 32%인 19개가 First-in-class(혁신신약)로 승인됐다.
또 58%인 34개는 희귀질환(Rare Diseases) 치료제로, 73%인 43개는 하나 이상의 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)를 통해 승인받았다.
59건 중 24건은 신속심사(Fast Track)로, 14건은 획기적치료(Breakthrough therapies)로, 43건은 우선심사(Priority Review) 대상으로 지정, 4건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
또 59건 중 71%인 42건은 다른 국가에서 승인받기 전에 미국에서 최초로 승인된 약물이다.

제약·바이오 기사
- 에제티미브+로수바스타틴, 부작용 내리고 효과 올리고 2019-03-12 12:00:05
- 메디포럼, 치매치료제 후보물질 'PM012' 임상 3상 돌입 2019-02-07 11:50:00
- 말트 림프종 헬리코박터 제균 실패…"방사선 대안" 2019-02-07 05:30:40
- CP강화·김영란법·지출보고서까지…"설 선물 실종" 2019-02-04 05:30:57
- 국산 보툴리눔 최초 미국 판매허가…나보타, FDA 승인 2019-02-02 11:13:57
제약·바이오 기사
많이 읽은 뉴스
이메일 무단수집 거부
메디칼타임즈 홈페이지에 게시된 이메일 주소가 전자우편 수집 프로그램이나
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.










- 최신순
- 추천순
댓글운영규칙ex) medi****** 아이디 앞 네자리 표기 이외 * 처리
댓글 삭제기준 다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입이 제한될 수 있습니다.
1. 저작권・인격권 등 타인의 권리를 침해하는 경우
2. 상용프로그램의 등록과 게재, 배포를 안내하는 게시물
3. 타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
4. 욕설 및 비방, 음란성 댓글